|
 |
| Ann Optom Contact Lens > Volume 23(1); 2024 > Article |
|
Abstract
방법
2017년 이후 본원에서 백내장 수술을 시행 받은 환자들 중 30명의 환자(평균 나이 68.26 ± 8.99세, 남성 14명, 여성 16명), 35안을 선정하였다. 수술 전 LOCS staging, 내피세포 수, 안압, 안축장 길이, 각막 굴절률의 정보를 후향적으로 분석하였다. 술 후 평균 경과 관찰기간은 3개월이었다. 술 후 1개월, 3개월 시점에서의 경미한 섬모체 소대 약화가 있는 환자군과 대조군에서의 구면대응치와 목표 굴절값의 차이의 절대값을 비교하였다.
Abstract
Purpose
To compare the clinical outcomes of one-piece aspheric intraocular lens in the patient group with mild zonule weakness and control group.
Method
Among the patients who underwent cataract surgery since 2017, 30 patients (average age of 68.26 ± 8.99 years, 14 men, 16 women) and 35 eyes were selected. Prior to surgery, information on LOCS staging, endothelial cell count, intraocular pressure, axial length, and corneal refractive index were analyzed retrospectively. The average follow-up period after surgery was 3 months. The absolute value of the difference between the spherical equivalent value and the target refractive value in the patient group and the control group at 1 month and 3 months after surgery was compared.
Results
The absolute value of the difference in refractive value after 1 month in the patient group was found was 0.61 ± 0.41 Diopters and 0.51 ± 0.42 Diopters in the control group, showing no statistically significant difference (p > 0.05). After 3 months, the absolute value of the refractive value difference was 0.46 ± 0.27 Diopters in the patient group and 0.46 ± 0.32 Diopters in the control group, indicating no statistically significant difference (p > 0.05).
Conclusions
The one-piece aspheric intraocular lens enVista MX60 does not show statistically significant clinical difference in the difference between the postoperative refractive value and the target refractive value in the patient group, so it may be actively considered for use in the patient with mild zonule weakness.
1967년 초음파유화술의 도입 이후, 백내장 수술은 현대 사회에서 가장 많이 이루어지고 있는 수술 중 하나이다[1]. 이러한 배경에는 다양한 기술의 발달이 있으며, 그중 인공수정체의 발달이 한 부분을 차지하고 있다[2,3]. 최근 들어 널리 이용되는 형태인 일체형 인공수정체 중, enVista MX60은 비교적 단단하다는 특징을 가지고 있으며, 측면에 창냄 구조가 위치하고 있어, Haptic에 가해지는 힘이 Optic에 전달되지 않게 하며 모서리 부분이 각져있어 후낭혼탁의 발생이 상대적으로 적다[4,5]. 이러한 인공수정체가 정확히 위치하기 위해서는 섬모체 소대의 역할이 매우 중요하다.
섬모체 소대란, 섬모체에 붙어있는 고리형의 섬유구조물로 수정체와 섬모체를 연결하는 구조를 말한다[6]. 이러한 해부학적 구조로 인해, 정상인에서 수정체는 고정된 상태가 아닌 부유 상태로 존재한다. 이러한 섬모체 소대는 외상, 고령 등에 의해 약화되는데[7-11], 백내장 수술에서 이러한 섬모체 소대의 약화는 성공적인 백내장 수술을 위해 반드시 고려되어야 하는 사항이다.
수술 전 섬모체 소대의 약화를 염두해 두어야 하는 경우는 거짓비늘증후군, 이전에 유리체 절제술을 한 환자, 외상성 백내장 환자, 고도 근시안, 망막색소변성증 환자, 포도막염 환자 그리고 결체조직질환을 가진 환자(Marfan syndrome, homocystinuria, hyperlysinemia, Ehler-Danlos syndromes, scleroderma, and Weill-Marchesani syndrome) 등이 있으며, 거짓비늘증후군이나 급성폐쇄각녹내장처럼 섬모체 소대가 동반될 확률이 높은 여러가지 질환들도 존재한다[12]. 다만, 섬모체 소대 약화의 정도를 수술 전 모두 파악할 수는 없으며, 수술 중 섬모체 소대 약화가 발견이 되는 경우도 적지 않다[13]. 수술 중 섬모체 소대 약화로 인해 인공수정체를 낭내에 안정적으로 위치시키기 어려운 경우, 수정체낭팽대고리 등의 방법을 통해 인공수정체를 안정화할 수 있다[14].
그러나 섬모체 소대 약화가 비교적 심하지 않은 경우에 대한 enVista MX60 인공수정체 사용의 임상양상에 관한 연구는 자세히 보고된 바가 없으므로 본 연구에서는 수술 중 발견된 경미한 섬모체 소대 약화 환자에서의 일체형 인공수정체 MX60 단독 사용 시 임상적 결과에 대해 알아보려 한다.
2017년 1월 1일부터 2022년 4월 20일까지 대구가톨릭대학교병원 안과를 방문하여 초음파수정체유화술 및 MX60 인공수정체 삽입술을 받은 환자들의 의무기록을 후향적으로 분석하였다. 수술 중 섬모체 소대 약화의 발견 유무에 따라 두 군으로 나누어 비교분석을 하기 위해, 본 연구에서는 1) 수정체낭 원형절개 도중 줄무늬 패턴이 나타난 경우, 2) 반복된 수력분리술 및 수력분층술 후에도 핵의 회전이 힘든 경우, 3) 수정체낭 뒷부분의 줄무늬가 나타나며 겉질의 제거가 힘든 경우 중 한 가지 이상의 소견이 수술 중 관찰되는 경우를 섬모체 소대의 약화로 정의하였다. 본 연구는 헬싱키 선언에 입각한 대구가톨릭대학교병원 생명윤리위원회의 승인 아래 진행되었다(승인번호 CR-22-085).
거짓비늘증후군 등 섬모체 소대를 약화시킨다고 알려진 질환 및 녹내장의 병력이 있었던 경우, 안구 및 두부외상의 과거력이 있었던 경우, 수술 전 검사에서 수정체떨림 등의 명백한 섬모체 소대 약화소견이 확인된 경우, 수술 중 심한 섬모체 소대가 소실이 의심되는 경우(수정체낭 가장자리가 관찰되는 경우, 전방내로 유리체가 탈출하는 경우, 수술 후 인공수정체가 중앙에서 이탈하는 경우), 후낭파열 및 안내염 등과 같은 수술 합병증이 발생한 경우는 제외하였다.
술전 백내장 진행정도(Lens Opacity Classification System, LOCS III staging), 내피세포, 안압, 안구생체계측기(IOLMaster 700; Carl Zeiss Meditec AG, Jena, Germany)로 측정한 안축장길이 및 각막굴절률과 술 후 1개월, 3개월째의 각막 내피세포 손실율을 비교하였다. 또한, 예상 굴절력에서 술 후 1개월, 3개월째의 현성 굴절력을 뺀 값을 예측오차로 정의하였으며, 예측오차의 절댓값을 절대오차로 정의하였다.
수술은 모두 한 명의 술자에 의해 실시되었으며, 0.5% proparacaine hydrochloride (Paracaine®; Hanmi, Korea)를 사용하여 점안마취 하에 진행하였다. 마취를 확인 후 각막 윤부의 이측과 비측에 각 1개의 절개창을 만들고, 전방 내 점탄물질을 주입한 뒤 지름 5.5 mm의 수정체낭 원형절개를 실시하였다. 이후 수력분리술 및 수력분층술을 시행하고 초음파유화술로 수정체핵을 제거하였고, 남은 수정체 겉질을 관류흡입기로 흡입하여 제거하였다. 점탄물질을 전방에 주입한 후 카트리지를 이용해 일체형 비구면 인공수정체(enVista, MX60; Bausch & Lomb, Rochester, NY, USA)를 낭내에 삽입하였고 남은 점탄물질을 모두 제거하였다. 인공수정체 도수는 안구생체계측(IOLMaster 700)을 실시하여 안축장길이를 확인하고, Sanders-Retzlaff-Kraff (SRK/T) 공식에서 0.0 디옵터보다 근시성이면서 가장 근접한 도수로 결정하였다. 절개창은 봉합하지 않고 관류액을 이용해 각 절개창의 양쪽 끝에서 부종을 만들어 폐쇄되도록 하였다. 수술 중 사용한 점탄물질은 모두 DisCoVisc (hyaluronic acid 1.6%-chondroitin sulfate 4.0%; Alcon laboratories, Fort Worth, TX, USA)였으며 수술 후 1개월 동안 levofloxacin 1.5% (Cravit®; Santen, Osaka, Japan)와 0.5% loteprednol etabonate (Lotemax®; Bausch + Lomb. Co., Ltd., Rochester, NY, USA)를 하루 4회 사용하였다.
통계학적 분석은 SPSS 버전 25.0 (IBM Corp, Armonk, NY, USA)을 이용하였으며, 두 군 간에 연속형 변수가 정규성검정을 만족할 시 independent t-test, 정규성검정을 만족하지 않을 시 Mann-Whitney U test를 이용하였고, 범주형 변수의 비교는 chi-square test 후 p값이 0.05 미만인 경우를 유의하다고 정의하였다.
수술 중 섬모체 소대 약화가 없었던 군을 group 1, 섬모체 소대 약화가 확인된 군을 group 2로 정의하였으며, 각각 24안, 11안이었다. Group 1의 평균연령은 68.42 ± 7.70세, 남자 11명, 여자 13명이었으며 좌안 11안, 우안 13안을 포함하였고, group 2는 평균 연령은 71.09 ± 11.56세, 남자 5명, 여자 6명이었으며 우안 7안, 좌안 4안을 포함하였다. 수술 전 확인된 두 군의 백내장 정도, 각막내피세포수, 각막 곡률계, 안축장길이 및 수술시간에서 유의미한 차이를 나타내지 않았다(Table 1).
Group 2에서 평균 내피세포 손실율이 group 1보다 수술 후 1개월/3개월째 모두 높았으나, 수술 후 1개월째의 손실률만 유의한 차이를 보였으며, 수술 후 3개월까지 세극등현미경으로 관찰된 전낭절개 위축, 인공수정체의 중심이탈, 인공수정체의 기울어짐은 두 군 모두 나타나지 않았다 (Table 2).
섬모체 소대 약화로 인한 과한 굴절변화를 확인하기 위한 예측/절대 오차분석에서, 예측오차는 두 군 모두 점차 근시성 변화를 보이고, 그 정도는 group 2에서 더 작았으나 통계적으로 유의한 차이는 보이지 않았다. 절대오차는 두 군 모두 점차 감소하는 것으로 나타났으며, 두 군 간에 유의한 차이는 없었다(Fig. 1).
최근 백내장 수술을 실시한 환자가 점차 증가하면서, 보다 성공적인 수술에 대한 관심도가 높아지고 있다. 이에 따라 다양한 인공수정체들이 출시되었으며, 어떤 인공수정체를 선정하는가 또한 중요한 관심사로 떠오르고 있다.
enVista MX60은 아치형의 Haptic 구조덕에 인공수정체가 수정체낭에 직접 접촉하게 되고, 내피세포 이동을 방지할 수 있다(Fig. 2). 또한 우수한 회전 안정성을 갖추고 있어, 92%의 환자에서 술 후 렌즈의 회전 정도가 5º 이내로 확인 되었다[4]. 굴절도의 변화 또한 술 후 2-3개월 뒤 0.01 디옵터, 3-4개월 뒤 0.10 디옵터 이내로 안정적인 것으로 알려져있다[4]. 다른 보고에 의하면, 수술 후 refractive error가 ± 0.5 디옵터 이내인 경우가 대부분이었으며[4] 이러한 다양한 장점을 가지고 있어 수술에 널리 사용되고 있다.
또한 광학부와 지지부 사이에 2개의 구멍이 있어 수정체낭과 섬모체 소대가 충분히 인공수정체를 지탱하지 못할 것으로 예상되는 환자에서 pseudo-4-point fixation 기법을 이용한 공막고정술을 시행하는 데에도 이용될 수 있다[12].
수정체낭 원형절개술 부위에서 수술 후 수정체낭의 위축은 다양한 정도로 나타날 수 있으며, 이러한 수정체낭의 위축은 거짓비늘증후군이나 포도막염 환자에서 섬모체 소대 약화가 동반되며 높은 발생 빈도를 나타내는 것으로 보고된 바 있다[15]. 이는 곧 인공수정체의 위치를 불안정하게 할 수 있으며, 시축이 이동되는 결과로 이어질 수 있다[16]. 또한 술 후 수정체낭의 위축이 발생하게 되면 경도가 상대적으로 낮은 인공수정체의 경우 수정체낭 위축의 힘에 의해 모양이 변형되어 난시, 근시, 원시 등의 굴절 오차가 발생할 확률이 높다고 알려져 있으며, 수축의 힘에 잘 견딜 수 있는 튼튼한 인공수정체를 사용하는 것이 좋다고 보고된 바 있다[9,17,18]. 또한 수정체낭 위축의 치료로 알려져 있는 Nd:Yag laser에 대해서 MX60의 경우 연성 인공수정체에 비해 상대적으로 높은 저항성을 가진 것으로 알려져 있다[15,19].
따라서 비교적 단단한 MX60은 섬모체 소대 약화가 있는 환자에서 상대적으로 많이 발생할 수 있는 수정체낭의 위축에 대하여 적절한 인공수정체로 고려해볼 수 있다.
단, 이는 생체 외 환경에서 강한 물리력으로 인공수정체에 압력을 가했을 때 나타나는 변화를 분석한 것이므로, 생체 내에서 수정체낭 위축에 의한 압력이 가해질 때 변화에 대해서는 추가적인 연구가 필요할 것으로 생각된다.
본 연구 결과 섬모체 소대 약화로 인한 굴절도 변화도 두 군 간의 유의한 차이가 보이지 않았으며, 굴절값 예측오차는 시간이 지날수록 두 군 모두 근시성 변화를 보이나, 그 정도는 오히려 group 2에서 더 작았다. 굴절값 절대오차는 두 군 모두 점차 감소하는 것으로 나타났으며, 두 군 간 유의한 차이는 없었다. 따라서 수술 중 발견되는 경미한 섬모체 소대의 약화가 MX60의 축성이탈을 일으킬 만큼 강한 압력을 주지는 못한다고 할 수 있다.
그러나 이는 동일조건에서 삽입된 다른 인공수정체와 비교를 해보지는 못하였기 때문에, 여러가지 인공수정체를 다양하게 비교 분석해 보는 것이 필요하다. 또한 IOL Master 700의 도입 이후, 조건을 동일시한 대상자수를 확보하는 데에 어려움이 있어 충분한 수의 대상자를 확보하지 못한 한계가 있다.
평균 내피세포 손실율에서 group 2가 group 1보다 수술 후 1개월, 3개월째에 모두 높았으나 수술 후 1개월째의 차이만 통계적으로 유의한 차이를 보였다. 내피세포 손실률은 수술시간, 그중에서도 특히 초음파에너지의 사용시간이 주된 영향을 끼치는 것으로 알려져 있다[20,21]. 다만 본 연구에서는 초음파에너지 사용시간을 의무기록상 확인할 수 없어 기록되지 않았기에, 본 연구의 parameter상 수술시간이 더 소요된 것을 통해 수술 시간이 영향을 준 것으로 생각해 볼 수 있다.
그러나 내피세포 손실율의 차이가 시간이 지남에 따라 유의하지 않음으로 바뀌는 것을 볼 때, 장기적으로는 큰 차이가 나타나지 않는다고 할 수 있다.
안축장 길이가 짧을수록 내피세포 손실에 영향을 주는 것으로 알려져 있는데[21,22], 본 연구의 parameter상 유의한 차이가 거의 없음을 확인하였고, 전방의 깊이가 얕을수록 내피세포에 큰 손상을 준다고 알려져 있으나[21] 본 연구에서는 해당 parameter에 대한 분석이 이루어 지지 않았다.
동일조건의 대상자 수를 많이 확보하지 못한 점, 수술 후 경과관찰 기간이 3개월로 비교적 길지 않은 점, 섬모체 소대 약화를 정량화하지는 못했다는 점 등이 본 연구의 약점으로 작용하지만, 수술 전 섬모체 소대 약화의 저명한 징후 없이 수술 중 경미한 섬모체 소대 약화가 발견되는 경우, 3-piece IOL이나 CTR 등의 수술을 복잡하게 하는 추가적인 처치 없이 enVista MX 60의 단독 사용만으로도 섬모체 소대 약화가 없는 일반적인 경우와 임상경과가 크게 다르지 않았다. 따라서 수술 중 발견된 경미한 섬모체 소대 약화환자의 백내장 수술 시, 인공수정체를 선택하는 데 있어서 인공수정체 선택 및 추가 처치 여부를 결정하는 데에 도움이 될 것으로 생각된다.
Figure 1.
Comparison of prediction/absolute refractive errors in group with intraoperative zonule weakness or not. (A) Group 2 showed less amount of predicted refractive error than group1, but not significant. (B) Both groups showed gradual decrease of absolute refractive error, but there was no significant difference. Pred = predicted refractive error; Abs = absolute refractive error; m = month; Group 1 = no zonule weakness; Group 2 = Zonule weakness. Abs at 1 month was analyzed with Mann-Whitney U test. Pred at 1, 3 month and abs at 3 month were analyzed with independent t-test.
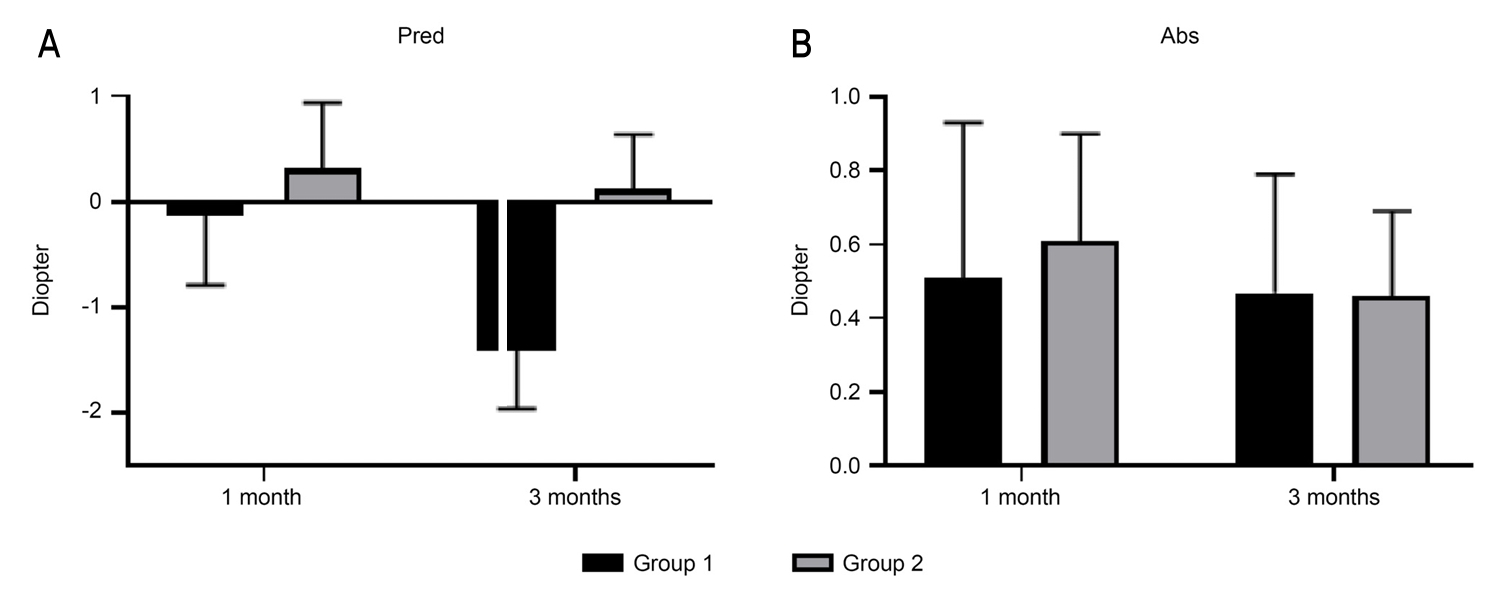
Figure 2.
Enlarged photographs of MX60. (A) Design of the MX60 intraocular lens (Bausch & Lomb, Rochester, NY, USA). (B) Posterior surface facing toward the right side of the page.

Table 1.
Preoperative condition of group with intraoperative zonular weakness or not
| Variable | Group 1 (n = 24) | Group 2 (n = 11) | p-value |
|---|---|---|---|
| Age (years) | 68.42 ± 7.70 (55-83) | 71.09 ± 11.56(42-83) | 0.133* |
| Sex, M:F | 11 (0.46):13 (0.54) | 5 (0.45):6 (0.55) | 0.983† |
| Site (OD/OS) | 11 (0.46):13 (0.54) | 7 (0.64):4 (0.36) | 0.328† |
| LOCS III NC | 2.54 ± 0.66 | 2.82 ± 0.75 | 0.535† |
| LOCS III N | 2.67 ± 0.82 | 2.91 ± 0.54 | 0.566† |
| LOCS III C | 2.83 ± 0.76 | 2.91 ± 0.54 | 0.233† |
| LOCS III P | 2.13 ± 0.80 | 2.27 ± 0.47 | 0.328† |
| Endothelial cell count (numbers) | 2,714.25 ± 486.54 | 2,743.91 ± 453.14 | 0.865‡ |
| Mean keratometry (diopter) | 44.14 ± 1.38 | 44.15 ± 1.80 | 0.981‡ |
| Flat keratometry (diopter) | 43.79 ± 1.35 | 43.66 ± 1.83 | 0.814‡ |
| Steep keratometry (diopter) | 44.49 ± 1.43 | 44.65 ± 1.84 | 0.784‡ |
| Axial length (mm) | 23.67 ± 0.55 | 23.65 ± 0.99 | 0.955‡ |
| Operation time (minutes) | 17.49 ± 3.53 | 20 ± 6.50 | 0.352‡ |
Values are presented as mean ± standard deviation (range) or number (%).
Group 1 = patients without any sign of zonule weakness; Group 2 = patients with intraoperative zonule weakness; M = male; F = female; OD = oculus dexter; OS = oculus dexter; LOCS = Lens Opacity Classification System; NC = nuclear color; N = nuclear opalescent; C = cortical; P = posterior subcapsular opacity.
REFERENCES
2) Wi JM, Moon HS, Kim KH, Shyn KH. 2012 survey of KSCRS and KOS member: current trends in cataract surgery in Korea. J Korean Ophthalmol Soc 2015;56:1181-7.

3) Leaming DV. Practice styles and preferences of ASCRS members--2002 survey. J Cataract Refract Surg 2003;29:1412-20.


4) Packer M, Fry L, Lavery KT, et al. Safety and effectiveness of a glistening-free single-piece hydrophobic acrylic intraocular lens (enVista). Clin Ophthalmol 2013;7:1905-12.



5) Heiner P, Ligabue E, Fan A, Lam D. Safety and effectiveness of a single-piece hydrophobic acrylic intraocular lens (enVista®) - results of a European and Asian-Pacific study. Clin Ophthalmol 2014;8:629-35.


6) Yaguchi S, Yaguchi S, Yagi-Yaguchi Y, et al. Objective classification of zonular weakness based on lens movement at the start of capsulorhexis. PLoS One 2017;12:e0176169.



7) Gimbel HV, Condon GP, Kohnen T, et al. Late in-the-bag intraocular lens dislocation: incidence, prevention, and management. J Cataract Refract Surg 2005;31:2193-204.


8) Gross JG, Kokame GT, Weinberg DV; Dislocated In-The-Bag Intraocular Lens Study Group. In-the-bag intraocular lens dislocation. Am J Ophthalmol 2004;137:630-5.


10) Jehan FS, Mamalis N, Crandall AS. Spontaneous late dislocation of intraocular lens within the capsular bag in pseudoexfoliation patients. Ophthalmology 2001;108:1727-31.


11) Masket S, Osher RH. Late complications with intraocular lens dislocation after capsulorhexis in pseudoexfoliation syndrome. J Cataract Refract Surg 2002;28:1481-4.


12) Lee SY, Cho YK. The effect of scleral sutured intraocular lens with optic-haptic junction fixation in the capsular bag. J Korean Ophthalmol Soc 2021;62:1172-80.

13) Arbisser LB. Managing intraoperative complications in cataract surgery. Curr Opin Ophthalmol 2004;15:33-9.


14) Park JW, Jung HH, Park SW. The effect of capsular tension ring in patients with a history of acute primary angle closure. J Korean Ophthalmol Soc 2013;54:1395-400.

15) Sung MK, Lee KH. The evaluation of capsule contraction syndrome. J Korean Ophthalmol Soc 1995;36:1454-61.
16) Lane S, Collins S, Das KK, et al. Evaluation of intraocular lens mechanical stability. J Cataract Refract Surg 2019;45:501-6.


17) Hansen SO, Crandall AS, Olson RJ. Progressive constriction of the anterior capsular opening following intact capsulorhexis. J Cataract Refract Surg 1993;19:77-82.


18) Levy JH, Pisacano AM, Anello RD. Displacement of bag-placed hydrogel lenses into the vitreous following neodymium: YAG laser capsulotomy. J Cataract Refract Surg 1990;16:563-6.


19) Ton Van C, Tran THC. Incidence of posterior capsular opacification requiring Nd:YAG capsulotomy after cataract surgery and implantation of enVista® MX60 IOL. J Fr Ophtalmol 2018;41:899-903.


20) Walkow T, Anders N, Klebe S. Endothelial cell loss after phacoemulsification: relation to preoperative and intraoperative parameters. J Cataract Refract Surg 2000;26:727-32.


-
METRICS

-
- 0 Crossref
- 0 Scopus
- 446 View
- 3 Download
- Related articles
-
Scleral Fixation of a Single-Piece AcrySof Toric Intraocular Lens: A Case Report2023 December;22(4)
Clinical Use of Mini-Scleral Contact Lens in Ocular Surface Diseases2022 September;21(3)
Clinical Results of Hydrogel Inlay for Presbyopia in Korea2016 June;15(2)
The Clinical Results of Wearing Orthokeratology Lenses in Children2015 March;14(1)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print