|
 |
| Ann Optom Contact Lens > Volume 22(4); 2023 > Article |
|
Abstract
ļ¬®ņĀü
ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØĆ ĒØöĒĢ£ ņĢłĻĄ¼Ēæ£ļ®┤ ņ¦łĒÖśņ£╝ļĪ£ ņŻ╝ļ│Ć ĒÖśĻ▓ĮņØś ņśüĒ¢źņØä ļ░øņØä ņłś ņ׳ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØĻ│╝ ļīĆĻĖ░ ņśżņŚ╝ļ¼╝ņ¦łĻ│╝ņØś Ļ┤ĆļĀ©ņä▒ņØä ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
ļīĆņāüĻ│╝ ļ░®ļ▓Ģ
ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”Øņ£╝ļĪ£ ņ¦äļŗ©ļÉ£ ņ┤Ø 216ļ¬ģņØä ļīĆņāüņ£╝ļĪ£ ĒøäĒ¢źņĀü ļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ļ¦żļŗ¼ ņŗĀĒÖś 18ļ¬ģņØä ļō▒ļĪØĒĢśņśĆļŗż. ņĢłĻĄ¼Ēæ£ļ®┤ ņ×ÉĻ░üņ”ØņāüņĀÉņłś ņäżļ¼ĖņĪ░ņé¼(OSDI), ļłłļ¼╝ļ¦ēĒīīĻ┤┤ņŗ£Ļ░ä(TFBUT), Ļ░üļ¦ēņŚ╝ņāēņĀÉņłś(FCS), ņē¼ļź┤ļ©ĖĻ▓Ćņé¼(ST1)ļź╝ ņŗ£Ē¢ēĒĢśņśĆĻ│Ā ĻĖ░ņāüņ▓ŁņŚÉņä£ ņĀ£Ļ│ĄĒĢ£ 2018ļģä 12Ļ░£ņøöņØś ļīĆĻĖ░ņśżņŚ╝ļåŹļÅä ļŹ░ņØ┤Ēä░ļź╝ ņ¢╗ņŚłļŗż. PM10Ļ│╝ PM2.5 ĒÅēĻĘĀĻ░ÆņØä ĻĖ░ņżĆņ£╝ļĪ£ ļ»ĖņäĖļ©╝ņ¦Ć ļåŹļÅäĻ░Ć ļåÆņØĆ ņŗ£ĻĖ░(H-PM)ņÖĆ ļé«ņØĆ ņŗ£ĻĖ░(L-PM)ņŚÉ ļģĖņČ£ļÉ£ ĻĘĖļŻ╣ņ£╝ļĪ£ ļéśļłĀ ļČäņäØĒĢśņśĆļŗż.
Ļ▓░Ļ│╝
ĒÖśņ×ÉļōżņØĆ ļåÆņØĆ OSDI, ļé«ņØĆ TFBUT, FCS ņ”ØĻ░Ć, ST1 Ļ░Éņåī ņåīĻ▓¼ņØä ļ│┤ņØ┤ļŖö ņżæļō▒ļÅäņØś Ļ▒┤ņä▒ņĢł ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż. 2018ļģäļÅÖņĢł ļ»ĖņäĖļ©╝ņ¦Ć ļåŹļÅäņØś ņøöļ│ä ņČöņØ┤ļź╝ ļ│┤ļ®┤ 5ņøöļČĆĒä░ 10ņøöĻ╣īņ¦ĆļŖö ļé«ņØĆ ļ»ĖņäĖļ©╝ņ¦Ć ļåŹļÅäļź╝ ļ│┤ņśĆĻ│Ā 1ņøöļČĆĒä░ 4ņøöĻ╣īņ¦Ć ĻĘĖļ”¼Ļ│Ā 11ņøöĻ│╝ 12ņøöņŚÉļŖö ļåÆņØĆ ļ»ĖņäĖļ©╝ņ¦Ć ļåŹļÅäļź╝ ļ│┤ņśĆļŗż. ĒĢśņ£äĻĘĖļŻ╣ Ļ│Āļ»ĖņäĖļ©╝ņ¦ĆņŚÉ ļģĖņČ£ļÉ£ ĒÖśņ×ÉļōżņØĆ ņĀĆļ»ĖņäĖļ©╝ņ¦ĆņŚÉ ļģĖņČ£ļÉ£ ĒÖśņ×Éļōżļ│┤ļŗż ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī ļåÆņØĆ OSDI, FCSņÖĆ ļé«ņØĆ ST1ņØä ļ│┤ņśĆļŗż. ĻĘĖļ¤¼ļéś ļæÉ ĻĘĖļŻ╣ņŚÉņä£ TFBUTļŖö ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż.
Ļ▓░ļĪĀ
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØś ņŻ╝ņÜöņØĖņ×ÉņØĖ ļłłļ¼╝ļ¦ē ļČłņĢłņĀĢņä▒ņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņØīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā, Ļ│Āļ»ĖņäĖļ©╝ņ¦ĆņŚÉ ļģĖņČ£ļÉ£ ĻĄ░ņŚÉņä£ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØ┤ ļŹö ņŗ¼ĒĢśĻ▓ī ļéśĒāĆļé©ņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż. ļ»ĖņäĖļ©╝ņ¦ĆĻ░Ć ļåÆņØĆ ņŗ£ĻĖ░ņŚÉ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØ┤ ņĢģĒÖöļÉĀ ņłś ņ׳ņ£╝ļ®░, ņØ┤ļŖö ĒÖśĻ▓Į ņŚ╝ņ”Ø ņ£Āļ░£ ņØĖņ×ÉļōżņØ┤ ļłłļ¼╝ ļČäļ╣ä ļ░Å ņĢłĻĄ¼Ēæ£ļ®┤ņŚÉ ņśüĒ¢źņØä ņżĆļŗżļŖö Ļ▓āņØä ņŗ£ņé¼ĒĢ£ļŗż.
Abstract
Purpose
Dry eye disease (DED) has become a common ocular surface disorder in the recent decades, which can be influenced by environmental factors. This study aimed to examine the clinical association between DED and ambient air pollutants.
Methods
A total of 216 patients (18 patients per each month) diagnosed with DED were enrolled in this retrospective study. Ocular surface disease index (OSDI), tear film breakup time (TFBUT), fluorescein corneal staining (FCS), and SchirmerŌĆÖs test 1 (ST1) were examined. The monthly concentrations of air pollutants in 2018 were obtained from the data released by the Korean Ministry of Environment. Based on the mean of PM10 and PM2.5, subgroup with exposure to low (L-PM) or high concentration of PM (H-PM) was analyzed.
Results
Patients had moderate DED as high OSDI, low TFBUT, increased FSC, and decreased ST1. During the year 2018, monthly variation of PM showed that May to October was the period of L-PM and January to April and November to December was the period of H-PM. In subgroup analysis, patients in H-PM showed significantly higher OSDI, FCS, and lower ST1 compared to in L-PM. However, there was no significant difference in TFBUT between subgroups.
ĒÖśĻ▓Į ņśżņŚ╝ņŚÉ ļīĆĒĢ£ ņØĖļźśņØś Ļ┤Ćņŗ¼ņØĆ ņĀÉņĀÉ ļŹö Ļ│ĀņĪ░ļÉśĻ│Ā ņ׳ņ£╝ļ®░, ļ¦ÄņØĆ ņŚ░ĻĄ¼ņŚÉņä£ ĒÖśĻ▓Į ņśżņŚ╝ņØ┤ ņØĖĻ░äņØś Ļ▒┤Ļ░ĢņØä ļŗżļ░®ļ®┤ņ£╝ļĪ£ ĒĢ┤ņ╣Ā ņłś ņ׳ņØīņØä ļ│┤ņŚ¼ņŻ╝Ļ│Ā ņ׳ļŗż[1-3]. ņ×ģņ×Éņāü ļ¼╝ņ¦ł(particulate matter, PM)ņØĆ ņĀäņäĖĻ│äņĀüņØĖ ļīĆĻĖ░ņśżņŚ╝ ļ¼╝ņ¦łņØ┤ļ®░ Ļ│ĄĻĖ░ ņżæņŚÉ ļ¢ĀļŗżļŗłļŖö Ļ│Āņ▓┤ ļ░Å ņĢĪņ▓┤ ņ×ģņ×ÉņØś Ēś╝ĒĢ®ļ¼╝ļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ļŖöļŹ░, ņ¦üĻ▓ĮņØ┤ 10 ╬╝m ļ»Ėļ¦īņØĖ PMņØä ļ»ĖņäĖļ©╝ņ¦Ć(PM10), 2.5 ╬╝m ļ»Ėļ¦īņØä ņ┤łļ»ĖņäĖļ©╝ņ¦Ć(PM2.5)ļØ╝Ļ│Ā ĒĢśņŚ¼ ļīĆĻĖ░ ņśżņŚ╝ņØś ņŗ¼Ļ░üņä▒ņØä ĒÅēĻ░ĆĒĢśļŖö ņ¦ĆĒæ£ ņżæ ĒĢśļéśņØ┤ļŗż. ņŻ╝ļĪ£ ņŚ░ļŻīņØś ņŚ░ņåī(ņ×ÉļÅÖņ░© ļ░░ĻĖ░ ļ░Å ņäØĒāä ņŚ░ņåī ļō▒)ņŚÉņä£ ļ╣äļĪ»ļÉśļ®░ ļ¦ÄņØĆ ņ¢æņØś ņ£ĀĻĖ░ ļ¼╝ņ¦ł(ļ▓żņĪ░ Ēö╝ļĀī ļ░Å ļŗżĒÖś ļ░®Ē¢źņĪ▒ ĒāäĒÖöņłśņåī ļō▒)ņØä ĒżĒĢ©ĒĢśņŚ¼ ļ¦żņÜ░ ļ│Ąņ×ĪĒĢ£ ĻĄ¼ņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ£╝ļ®░ ņłśļ¦ÄņØĆ ļ¼┤ĻĖ░ ĻĄ¼ņä▒ ņÜöņåī, ĒÖ®ņé░ņŚ╝, ņ¦łņé░ņŚ╝ ļ░Å ņżæĻĖłņåŹ(ļé® ļ░Å ļŗłņ╝ł) ļō▒ņØä ĒżĒĢ©ĒĢ£ļŗż. PMņØĆ ĒÅÉļĪ£ ĒØĪņ×ģļÉśņ¢┤ ņ¦üņĀæņĀüņ£╝ļĪ£ ņ▓£ņŗØ, ĒÅÉņćäņä▒ ĒÅÉņ¦łĒÖś ļō▒ņØś ĒśĖĒØĪĻĖ░ņ¦łĒÖśņØä ņØ╝ņ£╝Ēéżļ®░, ņĀ£Ļ▒░ļÉśņ¦Ć ļ¬╗ĒĢ£ ņ▒ä ņĀäņŗĀ ĒśłļźśļĪ£ ĒØĪņłśļÉśņ¢┤ ļćīĻ▓Įņāē, ņŗ¼ĻĘ╝Ļ▓Įņāē ļō▒ņØś ņŗ¼ļćīĒśłĻ┤Ć ņ¦łĒÖś ļ░Å ņĢīņĖĀĒĢśņØ┤ļ©Ė ļō▒ņØś Ēć┤Ē¢ēņä▒ ļćīņ¦łĒÖśĻ╣īņ¦ĆļÅä ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[4-9].
ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØĆ ļłłļ¼╝ļ¦ēņØś ņĢłņĀĢņä▒ ļ░Å ĒĢŁņāüņä▒ ņåīņŗżļĪ£ ņØĖĒĢśņŚ¼ ņĢłĻĄ¼ Ēæ£ļ®┤ņØś ņåÉņāüņØä ņ£Āļ░£ĒĢśļŖö ņŚ╝ņ”Øņä▒ ļ®┤ņŚŁ ņ¦łĒÖśņ£╝ļĪ£, ļŗżņ¢æĒĢ£ ņØĖņ×ÉĻ░Ć Ļ┤ĆņŚ¼ĒĢśņŚ¼ Ļ░ĆļĀżņøĆ, ļ╣ø ļ▓łņ¦É, ņØ┤ļ¼╝Ļ░É ļō▒ņŚÉņä£ļČĆĒä░ ņŗ£ļĀźņĀĆĒĢś, ļłł ĒåĄņ”Ø ļō▒ņØś ņŗ¼Ļ░üĒĢ£ ņĢłĻĄ¼ ņ”ØņāüņØä ņØ╝ņ£╝Ēé¼ ņłś ņ׳ļŗż[10-12]. ņØ┤ļ¤¼ĒĢ£ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØĆ Ļ░Ćņן ĒØöĒĢ£ ņĢłĻĄ¼ Ēæ£ļ®┤ ņ¦łĒÖśņ£╝ļĪ£, ņŚ¼ļ¤¼ ĻĄŁĻ░ĆņŚÉņä£ ņŗżņŗ£ļÉ£ ļ¦ÄņØĆ ņŚ░ĻĄ¼ļōżņØś ļ│┤Ļ│ĀņŚÉ ļö░ļź┤ļ®┤ ĻĘĖ ņ£Āļ│æļźĀņØ┤ 34%Ļ╣īņ¦Ć ļŗ¼ĒĢ£ļŗż[13]. ļ┐Éļ¦ī ņĢäļŗłļØ╝, ļłłņØś ĻĖ░ļŖźņŚÉ ņśüĒ¢źņØä ņŻ╝ļŖö Ļ▓ā ņÖĖņŚÉļÅä ĒÖśņ×ÉņØś ņØ╝ņāü ĒÖ£ļÅÖ, ņĀĢņä£ ļō▒ ļŗżņ¢æĒĢśĻ▓ī ņéČņØś ņ¦łņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ļŗż[14]. ļ¦żņÜ░ ĒŖ╣ņ¦ĢņĀüņ£╝ļĪ£ ļŗżļźĖ ņןĻĖ░ņÖĆ ļŗ¼ļ”¼, ņĢłĻĄ¼ ļ░Å ļłłļ¼╝ņØĆ ĒĢŁņŗ£ ļīĆĻĖ░ ĒÖśĻ▓ĮņŚÉ ļģĖņČ£ļÉśņ¢┤ ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”Ø ņŚŁņŗ£ ĒÖśĻ▓ĮņĀü ņÜöņØĖņØś ņśüĒ¢źņØ┤ Ēü¼Ļ▓ī ņ×æņÜ®ĒĢ£ļŗż. ļīĆĻĖ░ ĒÖśĻ▓ĮņØś ņśżņŚ╝ļ¼╝ņ¦łņØĖ PMņØ┤ ņĢłĻĄ¼ Ēæ£ļ®┤ņŚÉ ļ»Ėņ╣śļŖö ĻĖ░ņĀäņØä ļ░ØĒ׳ĻĖ░ ņ£äĒĢśņŚ¼, ļŗżņ¢æĒĢ£ ņĢłĻĄ¼ Ēæ£ļ®┤ ņäĖĒżņŻ╝ ļ¬©ļŹĖ ņŗżĒŚś[15-18] Ēś╣ņØĆ ļÅÖļ¼╝ ļ¬©ļŹĖ ņŗżĒŚś[18-24] ļō▒ņØś ĻĖ░ņ┤łņŚ░ĻĄ¼Ļ░Ć ĒÖ£ļ░£Ē׳ ņØ┤ļŻ©ņ¢┤ņ¦ĆĻ│Ā ņ׳ļŗż.
ņĢłĻĄ¼ Ēæ£ļ®┤ņØĆ ļīĆĻĖ░ ĒÖśĻ▓ĮĻ│╝ ĒĢŁņŗ£ ņĀæņ┤ēĒĢśļŖö ĒŖ╣ņä▒ņ£╝ļĪ£ ņØĖĒĢśņŚ¼ PMņØ┤ ņ¦üņĀæņĀüņØĖ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ņØīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā, ņĢłĻĄ¼ Ēæ£ļ®┤ ņ¦łĒÖśņØś ļ░£ņāØņŚÉ ļīĆĒĢ┤ PMĻ│╝ņØś ņŚ░Ļ┤Ćņä▒ņØä ņĢīņĢäļ│Ė ņ×äņāü ņŚ░ĻĄ¼ļŖö ļ¦Äņ¦Ć ņĢŖļŗż[25-30]. Ļ│╝Ļ▒░ ļ│┤Ļ│ĀļÉ£ ĒāĆ ĻĄŁĻ░ĆņØś ņŚŁĒĢÖ ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤, ļīĆļ¦īņŚÉņä£ ņĢłĻĄ¼ Ēæ£ļ®┤ ņ¦łĒÖś ņżæ ļ╣äĒŖ╣ņØ┤ņĀü Ļ▓░ļ¦ēņŚ╝ņØś ņ£Āļ│æļźĀņØĆ PM10ņØś ļåŹļÅäņŚÉ ļö░ļØ╝ ņ”ØĻ░ĆĒĢ£ļŗżĻ│Ā ĒĢśņśĆņ£╝ļ®░[28], ņżæĻĄŁņŚÉņä£ ņłśĒ¢ēĒĢ£ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØĻ│╝ PMņØś ņāüĻ┤ĆĻ┤ĆĻ│ä ņŚ░ĻĄ¼ņŚÉņä£ļŖö PM2.5Ļ░Ć ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ£äĒŚśņØĖņ×Éņ×äņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż.27 ĻĄŁļé┤ ņŚ░ĻĄ¼ ņżæņŚÉņä£ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØĻ│╝ PMĻ│╝ņØś Ļ┤ĆĻ│äļź╝ ņŚŁĒĢÖņĀüņ£╝ļĪ£ ļČäņäØĒĢ£ Ļ▓āļōżņØ┤ ņ׳ļŖöļŹ░, PM10ņØ┤ ņ£ĀņØśĒĢśĻ▓ī Ļ┤ĆļĀ©ņØ┤ ņ׳ļŗżļŖö ļ│┤Ļ│Ā[29]ņÖĆ ĻĘĖļĀćņ¦Ć ņĢŖļŗżļŖö ļ│┤Ļ│Ā[30]Ļ░Ć Ļ│ĄņĪ┤ĒĢ£ļŗż. ļśÉĒĢ£, ĻĄŁļé┤ņØś ĒŖ╣ņĀĢ ņ¦ĆņŚŁ ņØæĻĖēņŗżņŚÉ ļé┤ņøÉĒĢ£ ĒÖśņ×ÉļōżņØś ņČöņØ┤ļź╝ ļČäņäØĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö, Ļ▓░ļ¦ēņŚ╝ ļ░Å Ļ░üļ¦ēņŚ╝ņØä ņŻ╝ņåīļĪ£ ļé┤ņøÉĒĢ£ ĒÖśņ×ÉļōżņØś ļ╣äņ£©ņØ┤ PM10Ļ│╝ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ļŗżļŖö ņŚ░ĻĄ¼ļÅä ņ׳ļŗż[25].
ļ│Ė ņŚ░ĻĄ¼ļŖö 2018ļģä ĻĄŁļ»╝Ļ▒┤Ļ░Ģļ│┤ĒŚśĻ│Ąļŗ© ņØ╝ņé░ļ│æņøÉņŚÉ ļé┤ņøÉĒĢśņŚ¼ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØä ņ¦äļŗ©ļ░øņØĆ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ĒĢśņśĆĻ│Ā, ļŗ©ņł£Ē׳ ņ¦łĒÖśņØś ņ£Āļ¼┤ļ¦īņØä ĒÖĢņØĖĒĢśļŖö ņŚŁĒĢÖņĀü ņŚ░ĻĄ¼Ļ░Ć ņĢäļŗłļØ╝ ņĢłĻ│╝ņĀü ņĀäļ¼Ė ņ¦äļŻīļź╝ ĒåĄĒĢśņŚ¼ ņĢłĻĄ¼ Ēæ£ļ®┤ ņāüĒā£ļź╝ ļīĆļ│ĆĒĢĀ ņłś ņ׳ļŖö ĒŖ╣ņØ┤ ņ×äņāüņ¦ĆĒæ£ļōżņØä ļČäņäØĒĢśņśĆļŗż. ĒÖśņ×ÉļōżņØś Ļ▒░ņĀÉņØä ĒåĀļīĆļĪ£ ĒĢ┤ļŗ╣ ņ¦ĆņŚŁņØś PMņØä ĒżĒĢ©ĒĢ£ ļīĆĻĖ░ņśżņŚ╝ļ¼╝ņ¦łņØś ņŚ░ņżæ ļ│ĆĒÖöļź╝ ĒÖśĻ▓ĮļČĆļź╝ ĒåĄĒĢ┤ ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░, PM2.5 ļ░Å PM10ņØś ļåŹļÅäņŚÉ ļö░ļØ╝ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØś ņżæņ”ØļÅäņŚÉ ņ░©ņØ┤Ļ░Ć ņ׳ļŖöņ¦Ć ņĢīņĢäļ│┤ņĢśļŗż.
2018ļģä 1ņøöļČĆĒä░ 2018ļģä 12ņøöĻ╣īņ¦Ć ĻĄŁļ»╝Ļ▒┤Ļ░Ģļ│┤ĒŚśĻ│Ąļŗ© ņØ╝ņé░ļ│æņøÉņØä ļé┤ņøÉĒĢ£ ņ┤łņ¦ä ĒÖśņ×É ņżæ ļ¦ī 19ņäĖ ņØ┤ņāüņØś ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØä ņ¦äļŗ©ļ░øņØĆ ņä▒ņØĖ 216ļ¬ģņŚÉņä£, ņ”ØņāüņØ┤ ļŹö ņŗ¼ĒĢ£ ņ¬Į ļłłņØä ļīĆņāüņ£╝ļĪ£ ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ļź╝ ņ¦äĒ¢ēĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ļŖö ĻĄŁļ»╝Ļ▒┤Ļ░Ģļ│┤ĒŚśĻ│Ąļŗ© ņØ╝ņé░ļ│æņøÉ ĻĖ░Ļ┤Ćņ£żļ”¼ņ£äņøÉĒÜī(Institutional Review Board)ņØś ņŖ╣ņØĖ ĒĢśņŚÉ ņ¦äĒ¢ēļÉśņŚłņ£╝ļ®░ ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ļĪ£ ĒÖśņ×É ļÅÖņØśņä£ļŖö ļ®┤ņĀ£ ļ░øņĢśļŗż(IRB No. NHIMC 2018-04-030). ļ¬©ļōĀ ĒÖśņ×ÉļōżņØĆ ņØ┤ņĀäņŚÉ Ē׳ņĢīļŻ©ļĪĀņé░ ņÖĖņŚÉļŖö Ļ▒┤ņĪ░ņ”Ø ņ╣śļŻīņĀ£ļź╝ ņé¼ņÜ®ĒĢ£ Ļ│╝Ļ▒░ļĀźņØ┤ ņŚåņŚłļŗż. ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØĆ ņĢłĻĄ¼Ļ▒┤ņĪ░Ļ░É, ņØ┤ļ¼╝Ļ░É, ĒåĄņ”Ø, ņŗ£ļĀź ņĀĆĒĢś ļō▒ņØś ņ×ÉĻ░üņ”ØņāüņØ┤ ņ׳ņ£╝ļ®┤ņä£, ĒśĢĻ┤æ ņŚ╝ņāē ņāü ļłłļ¼╝ļ¦ēĒīīĻ┤┤ņŗ£Ļ░ä(tear film breakup time, TFBUT)ņØ┤ 5ņ┤ł ļ»Ėļ¦īņØ┤Ļ▒░ļéś ļśÉļŖö ņäĖĻĘ╣ļō▒ Ēśäļ»ĖĻ▓Į ņāü ĒśĢĻ┤æ ņŚ╝ņāēņ£╝ļĪ£ Ļ░üļ¦ē ņŚ╝ņāē ņĀÉņłś(fluorescein corneal staining, FCS)Ļ░Ć ĒÖĢņØĖļÉśļŖö Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆļŗż[11]. Ļ░üļ¦ē ņāüĒā£ņŚÉ ņśüĒ¢źņØä ņżä ņłś ņ׳ļŖö ļŗ╣ļć©ļéś ņŖżĒŗ░ļĖÉ-ņĪ┤ņŖ© ņ”ØĒøäĻĄ░, ļćīņ¦łĒÖś ņłśņłĀļĀź ļō▒ņØś ņĀäņŗĀ ņ¦łĒÖśņØ┤ ņ׳Ļ▒░ļéś ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”Ø ņÖĖ ļŗżļźĖ ņĢłĻĄ¼Ēæ£ļ®┤ ņ¦łĒÖśņØä Ļ░Ćņ¦ä ņ×É, Ļ░üļ¦ē ļÅģņä▒ņØ┤ ņĢīļĀżņ¦ä ņĀäņŗĀ ņĢĮļ¼╝ņ╣śļŻīļź╝ ļ░øĻ│Ā ņ׳Ļ▒░ļéś ļģ╣ļé┤ņן ņĀÉņĢłņĢĮņØä ņé¼ņÜ® ņżæņØĖ ņ×É, ņĮśĒāØĒŖĖļĀīņ”ł ņé¼ņÜ®ņ×É, ņĢłĻ│╝ņĀü ņłśņłĀļĀźņØ┤ ņ׳ļŖö ņ×É, ņĢłĻ│╝ņĀü ņÖĖņāüļĀźņØ┤ ņ׳ļŖö ņ×ÉļŖö ņŚ░ĻĄ¼ ļīĆņāüņŚÉņä£ ņĀ£ņÖĖĒĢśņśĆļŗż. ļ¬©ļōĀ ļīĆņāüņ×ÉļŖö ņ¦äļŻī ņĀä ņĢłĻĄ¼Ēæ£ļ®┤ ņ×ÉĻ░ü ņ”Øņāü ņĀÉņłś ņäżļ¼Ė ņĪ░ņé¼(ocular surface disease index, OSDI)ļź╝ ņ×æņä▒ĒĢ£ Ēøä, Schirmer strip (35 mm Whatman filter paper strip; Haag-Streit, Koeniz, Switzerland)ņØä ņĢäļל ļłłĻĄ¼ņäØ Ļ▓░ļ¦ēņŚÉ 5ļČäĻ░ä ļ¦łņĘ©ņŚåņØ┤ ņĀæņ┤ēĒĢśņŚ¼ ļłłļ¼╝ļ¤ēņØä ņĖĪņĀĢĒĢśņśĆļŗż(SchirmerŌĆÖs test 1, ST1) [31]. TFBUTņØś ņĖĪņĀĢņØĆ ĒöīļŻ©ņśżļĀłņŗĀ ņŚ╝ņāēņĢĮ(fluorescein strip; Haag-Streit)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ļ░üļ¦ēņØä ņŚ╝ņāēĒĢ£ Ēøä ĒÅēĻ░ĆĒĢśņśĆĻ│Ā ņĢłĻĄ¼Ēæ£ļ®┤ņØś ļ»Ėļ×Ć ņĀĢļÅäļŖö ĻĖ░ņĪ┤ņŚÉ ņĢīļĀżņ¦ä Oxford schemaņØś ĒöīļŻ©ņśżļĀłņŗĀ ņŚ╝ņāēņĢĮņØä ņØ┤ņÜ®ĒĢ£ Grading systemņØä ņé¼ņÜ®ĒĢśņśĆļŗż[32]. ļ¬©ļōĀ ļīĆņāüņ×ÉņØś ņĢłĻ│╝ņĀü ņØ┤ĒĢÖņĀü Ļ▓Ćņé¼ļŖö Ļ░ü ĒĢŁļ¬® Ļ░ä 10ļČä ņØ┤ņāüņØś Ļ░äĻ▓®ņØä ļæÉĻ│Ā ĒĢ£ ļ¬ģņØś ņĢłĻ│╝ ņĀäļ¼ĖņØś(JYW)ņŚÉ ņØśĒĢ┤ņä£ Ē¢ēĒĢ┤ņĪīļŗż.
PM10, PM2.5 ļ»ĖņäĖļ©╝ņ¦Ćļź╝ ļ╣äļĪ»ĒĢ£ sulfur dioxide (SO2), carbon monoxide (CO), ozone (O3), nitrogen dioxide (NO2) ļō▒ņØś ļīĆĻĖ░ņśżņŚ╝ļ¼╝ņ¦łņØś ļåŹļÅäļŖö ĒĢ£ĻĄŁĒÖśĻ▓ĮĻ│Ąļŗ©(www.airkorea.or.kr) ņŚÉņä£ ņĀ£Ļ│ĄĒĢśļŖö Ļ│ĄĻ░£ļŹ░ņØ┤Ēä░ļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż. ņĀäĻĄŁņØś ļīĆĻĖ░ņśżņŚ╝ ņĖĪņĀĢļ¦ØņŚÉņä£ ņĖĪņĀĢļÉśļŖö PM10, PM2.5, SO2, CO, O3, NO2 ļō▒ ļīĆĻĖ░ņśżņŚ╝ņØś ņ×ÉļŻīļź╝ ņłśņ¦æ┬ĘĻ┤Ćļ”¼ĒĢśļŖö ĻĄŁĻ░Ć ļīĆĻĖ░ņśżņŚ╝ ņĀĢļ│┤Ļ┤Ćļ”¼ ņŗ£ņŖżĒģ£(National Ambient air quality Monitoring Information System, NAMIS)ņØä ĒåĄĒĢśņŚ¼ ļīĆĻĖ░ĒÖśĻ▓ĮņĀĢņ▒ģ ņ×ÉļŻīļĪ£ ĒÖ£ņÜ®ĒĢĀ ņłś ņ׳ļÅäļĪØ ņĀ£Ļ│ĄĒĢśļŖö ņĀĢļ│┤ļĪ£ņŹ©, ņĀäĻĄŁ 112Ļ░£ ņŗ£, ĻĄ░ņŚÉ ņäżņ╣śļÉ£ 398Ļ░£ņØś ļÅäņŗ£ļīĆĻĖ░ ņĖĪņĀĢļ¦Ø, ļÅäļĪ£ļ│ĆļīĆĻĖ░ ņĖĪņĀĢļ¦Ø, ĻĄŁĻ░Ćļ░░Ļ▓Į ņĖĪņĀĢļ¦Ø, ĻĄÉņÖĖļīĆĻĖ░ ņĖĪņĀĢļ¦ØņŚÉņä£ ņĖĪņĀĢļÉ£ ļīĆĻĖ░ĒÖśĻ▓ĮĻĖ░ņżĆļ¼╝ņ¦łņØś ņĖĪ ņĀĢņ×ÉļŻīņØ┤ļŗż. ņØ┤ ņżæ, 2018ļģä 1ņøö 1ņØ╝ļČĆĒä░ 12ņøö 31ņØ╝Ļ╣īņ¦Ć ļ¦żņØ╝ ļ¦żņŗ£ļ¦łļŗż ņĖĪņĀĢļÉ£ ļīĆĻĖ░ņśżņŚ╝ļ¼╝ņ¦łņØś ļåŹļÅä ļŹ░ņØ┤Ēä░ļź╝ ņØ┤ņÜ®ĒĢśņśĆņ£╝ļ®░ ņøö ĻĖ░ņżĆņ£╝ļĪ£ ĒÅēĻĘĀ Ļ░ÆņØä ņé░ņČ£ĒĢśņśĆļŗż. ĻĘĖņżæ PM10Ļ│╝ PM2.5ņŚÉ ņ┤łņĀÉņØä ļ¦×ņČöņŚłĻ│Ā, Ļ░üĻ░üņØś ĒÅēĻĘĀĻ░ÆņØä ĻĖ░ņżĆņ£╝ļĪ£ ļ»ĖņäĖļ©╝ņ¦Ć ļåŹļÅäĻ░Ć ļåÆņØĆ ņŗ£ĻĖ░(subgroup of dry eye patients with exposure to high concentration of ambient particulate matter, H-PM)ņÖĆ ļé«ņØĆ ņŗ£ĻĖ░(subgroup of dry eye patients with exposure to low concentration of ambient particulate matter, L-PM)ļĪ£ ļéśļłäņ¢┤ ļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż. ļ│ĖņøÉņŚÉ ļé┤ņøÉĒĢśļŖö ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ņŚ░ĻĄ¼ļź╝ ņ¦äĒ¢ēĒĢśņśĆņ£╝ļ»ĆļĪ£, ņØ┤ļōżņØ┤ Ļ▒░ņŻ╝ĒĢśļŖö ņ¦ĆņŚŁ ļ░Å ļ│æņøÉ ņŻ╝ļ│ĆņØś ĒÖśņ×ÉļČäĒż ņ¦ĆņŚŁĻČīņØä ĒżĒĢ©ĒĢśņŚ¼ ļīĆĻĖ░ņśżņŚ╝ļ¼╝ņ¦ł ļåŹļÅä ņĪ░ņé¼ņØś ļ▓öņ£äļĪ£ ņĀĢĒĢśņśĆļŗż. ņ”ē, Ļ▓ĮĻĖ░ļÅä Ļ│Āņ¢æņŗ£, ĒīīņŻ╝ņŗ£, Ļ╣ĆĒżņŗ£, ņä£ņÜĖ ņØĆĒÅēĻĄ¼ ļō▒ņØś ņ¦ĆņŚŁņŚÉ ĒĢ£ĒĢśņŚ¼ ļīĆĻĖ░ņśżņŚ╝ ļŹ░ņØ┤Ēä░ļź╝ ĒÖ£ņÜ®ĒĢśņśĆļŗż. ĻĖ░ņāüņ▓Ł ļéĀņö©ļłäļ”¼(https://www.weather.go.kr)ņŚÉņä£ ņŚ░ĻĄ¼ ļ▓öņ£äļĪ£ ņäżņĀĢĒĢ£ ņ¦ĆņŚŁņŚÉņä£ ņ¢╗ņØä ņłś ņ׳ļŖö ļ▓öņ£ä ļé┤ņØś ņāüļīĆņŖĄļÅä ļŹ░ņØ┤Ēä░ļź╝ ņĀ£Ļ│Ąļ░øņĢä ņØ┤ņÜ®ĒĢśņśĆļŗż.
ĒåĄĻ│ä ļČäņäØņØĆ SPSS 21.0 ņåīĒöäĒŖĖņø©ņ¢┤(IBM Corp., Armonk, NY, USA)ļź╝ ņé¼ņÜ®Ē¢łļŗż. Ļ│ĀļåŹļÅä ļ»ĖņäĖļ©╝ņ¦Ć ĻĘĖļŻ╣(H-PM)Ļ│╝ ņĀĆļåŹļÅä ļ»ĖņäĖļ©╝ņ¦Ć ĻĘĖļŻ╣(L-PM) Ļ░äņØś ļČäņäØņØĆ Mann-Whitney test Ļ▓ĆņĀĢņØä ņØ┤ņÜ®ĒĢśņśĆļŗż. pĻ░ÆņØ┤ 0.05 ņØ┤ĒĢśņØĖ Ļ▓ĮņÜ░ļź╝ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉņĀĢĒ¢łļŗż.
2018ļģä 1ņøöļČĆĒä░ 12ņøö 31ņØ╝Ļ╣īņ¦Ć ļ│ĖņøÉ ņĢłĻ│╝ļź╝ ļé┤ņøÉĒĢ£ ĒÖśņ×É ņżæ, ļīĆņāüņ×É ņĀüņØæņ”ØņŚÉ ļČĆĒĢ®ĒĢ£ 216ļ¬ģ(216 ņĢł)ņØś ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”Ø ĒÖśņ×ÉĻ░Ć ņŚ░ĻĄ¼ņŚÉ ĒżĒĢ©ļÉśņŚłļŗż. ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØä ņ¦äļŗ©ļ░øņØĆ ĒÖśņ×ÉļōżņØĆ ņä▒ļ│äĻ│╝ ļéśņØ┤ļź╝ Ļ│ĀļĀżĒĢśņŚ¼ Ļ░ü ņøöļ│ä 18ļ¬ģņö® ĒøäĒ¢źņĀüņ£╝ļĪ£ ņäĀņĀĢļÉśņŚłĻ│Ā, ņĀäņ▓┤ ĒÖśņ×ÉļōżņØś ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ 58.4 ┬▒ 15.1ņäĖņśĆņ£╝ļ®░, 66.7%Ļ░Ć ņŚ¼ņä▒ņØ┤ņŚłļŗż.
ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņŚÉ Ļ┤ĆĒĢ£ ņ×äņāüņĀü ĒÅēĻ░Ćļź╝ ņŗ£Ē¢ēĒĢ£ Ļ▓░Ļ│╝, ĒÖśņ×ÉņØś ņŻ╝Ļ┤ĆņĀü ņ”ØņāüņØä ņłśņ╣śĒÖöĒĢ£ OSDI ņĀÉņłśļŖö ĒÅēĻĘĀ 27.9 ┬▒ 23.3ņĀÉ(ņżæņ£äņłś 22.5ņĀÉ)ņ£╝ļĪ£ ņżæļō▒ļÅä ņØ┤ņāüņØś ņżæņ”ØļÅäļź╝ ļ│┤ņśĆļŗż. ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØś ņŻ╝ņÜöĻĖ░ņĀä ņżæ ĒĢśļéśņØĖ ļČłņĢłņĀĢĒĢ£ ļłłļ¼╝ļ¦ēņØä ļīĆļ│ĆĒĢśļŖö ņ¦ĆĒæ£ņØĖ TFBUTļŖö ĒÅēĻĘĀ 4.5 ┬▒ 1.9ņ┤ł(ņżæņ£äņłś 4ņ┤ł)ļĪ£ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØś ņ¦äļŗ©ĻĖ░ņżĆņŚÉ ļČĆĒĢ®ĒĢśņśĆļŗż. ļłłļ¼╝ņØś ņāØņä▒ ļČäļ╣äļ¤ēņØä ļ£╗ĒĢśļŖö ST1 ņ¦ĆĒæ£ļŖö ĒÅēĻĘĀ 8.6 ┬▒ 2.3 mm (ņżæņ£äņłś 8 mm)ļĪ£ ņĢĮĻ░äņØś Ļ░ÉņåīļŖö ņ׳ņ£╝ļéś ņŗ¼ĒĢśņ¦ĆļŖö ņĢŖņĢśļŗż. ņĢłĻĄ¼Ēæ£ļ®┤ņØś FCS ņĀÉņłśļŖö ĒÅēĻĘĀ 1.8 ┬▒ 1.3 (ņżæņ£äņłś 1)ļĪ£, ļŗżņØĖņ×É ņŚ╝ņ”Øņ¦łĒÖśņØĖ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØś ļ│æņĀü ņ¢æņāüņŚÉ ļČĆĒĢ®ĒĢśņśĆļŗż(Table 1).
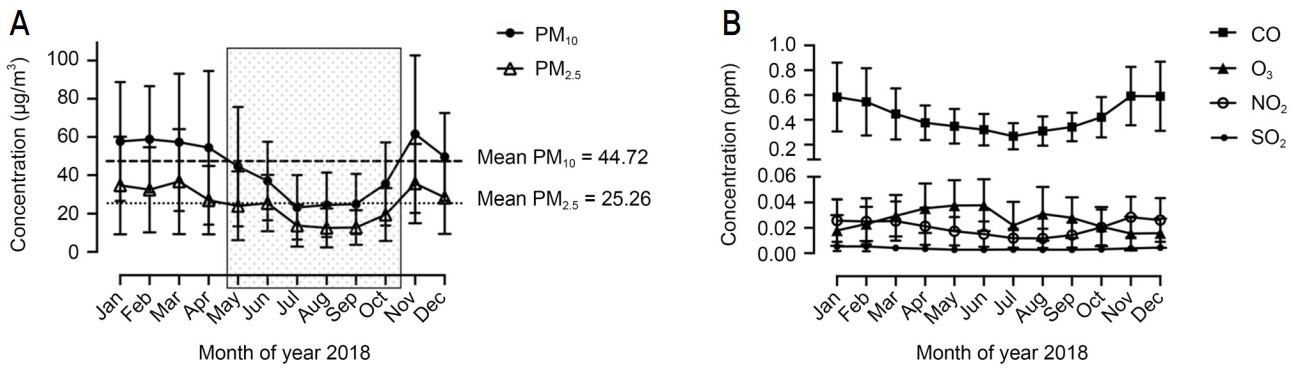
ĒĢ£ĻĄŁĒÖśĻ▓ĮĻ│Ąļŗ©ņŚÉņä£ ņĀ£Ļ│ĄĒĢśļŖö Ļ│ĄĻ░£ļŹ░ņØ┤Ēä░ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ 2018ļģä 1ņøöļČĆĒä░ 12ņøöĻ╣īņ¦Ć ļ¦żņØ╝ ĒĢ£ ņŗ£Ļ░ä Ļ░äĻ▓®ņ£╝ļĪ£ 24ņŗ£Ļ░ä ļé┤ļé┤ ņĖĪņĀĢļÉśļŖö PM10, PM2.5, SO2, CO, O3, NO2ņØś ļīĆĻĖ░ņśżņŚ╝ļ¼╝ņ¦ł ļåŹļÅäļź╝ ņé┤ĒÄ┤ļ│┤ņĢśĻ│Ā ĻĖ░ņāüņ▓Ł ļéĀņö©ļłäļ”¼ņŚÉņä£ ņĀ£Ļ│ĄĒĢśļŖö ņāüļīĆņŖĄļÅäļÅä ņé┤ĒÄ┤ļ│┤ņĢśļŗż. ņŚ░ĻĄ¼ ņ¦ĆņŚŁļ▓öņ£ä ļé┤ņŚÉņä£ ĒīīņŻ╝ņŗ£ņØś ņāüļīĆņŖĄļÅä ļŹ░ņØ┤Ēä░ļ¦ī ņ¢╗ņØä ņłś ņ׳ņŚłņ£╝ļ®░, ļŹ░ņØ┤Ēä░ļōżņØś Ļ░ü ņøöļ│ä ĒÅēĻĘĀ ņłśņ╣śļŖö Table 2ņÖĆ Ļ░Öļŗż. PM10ņØś 2018ļģä ņŚ░ĒÅēĻĘĀ ļåŹļÅäļŖö 44.72 ╬╝g/m3ņØ┤ņŚłĻ│Ā PM2.5ņØś 2018ļģä ņŚ░ĒÅēĻĘĀ ļåŹļÅäļŖö 25.26 ╬╝g/m3ņśĆļŗż. ņŚ░ĒÅēĻĘĀ ņāüļīĆņŖĄļÅäļŖö 72.92%ņśĆļŗż. ņØ┤ļź╝ ĻĖ░ņżĆņ£╝ļĪ£ Ļ░üĻ░üņØś ņøöļ│ä ļīĆĻĖ░ļåŹļÅäņØś ļČäĒżļź╝ ĻĄ¼ļČäĒĢ┤ļ│┤ļŗł ļæÉ Ļ░Ćņ¦Ć PMņŚÉņä£ Ļ│ĄĒåĄņĀüņ£╝ļĪ£ 5, 6, 7, 8, 9, 10ņøöņØś 6Ļ░£ņøöņØ┤ L-PMņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö ņŗ£ĻĖ░ņśĆĻ│Ā, 1, 2, 3, 4ņøö ļ░Å 11, 12ņøöņØś 6Ļ░£ņøöņØ┤ H-PMņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö ņŗ£ĻĖ░ņśĆļŗż(Fig. 1A). ņŚ░ĒÅēĻĘĀ ņāüļīĆņŖĄļÅäļź╝ ĻĖ░ņżĆņ£╝ļĪ£ ļČäļźśĒĢśļ®┤ L-PM ĻĖ░Ļ░äņŚÉ ļåÆņØĆ ņāüļīĆņŖĄļÅäĻ░Ć Ļ┤Ćņ░░ļÉśņŚłĻ│Ā, H-PM ĻĖ░Ļ░äņŚÉ ļé«ņØĆ ņāüļīĆņŖĄļÅäĻ░Ć ņĖĪņĀĢļÉśņŚłļŗż. H-PMĻ│╝ L-PMņ£╝ļĪ£ ĻĄ¼ļČäĒĢ£ ĻĖ░Ļ░ä ļÅÖņĢłņŚÉ, ļŗżļźĖ ļīĆĻĖ░ņśżņŚ╝ļ¼╝ņ¦łņØĖ CO, O3, NO2, SO2ļŖö ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(Fig. 1B).
H-PMĻ│╝ L-PMņ£╝ļĪ£ ĻĄ¼ļČäĒĢ£ ĻĖ░Ļ░äņØś ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”Ø ĒÖśņ×ÉļōżņØś ņ”Øņāü ļ░Å ņ×äņāü ņåīĻ▓¼ņØä ļ╣äĻĄÉĒĢ┤ļ│┤ņĢśļŗż. Table 3Ļ│╝ Ļ░ÖņØ┤ ļæÉ ĒĢśņ£äĻĘĖļŻ╣ņØĆ ļÅÖņØ╝ĒĢśĻ▓ī 6Ļ░£ņøöņØś ĻĖ░Ļ░äņŚÉ ĒĢ┤ļŗ╣ļÉśļ»ĆļĪ£ Ļ░üĻ░ü 108ļ¬ģņØś ĒÖśņ×É ļŹ░ņØ┤Ēä░ļź╝ ĒĢśņ£äĻĘĖļŻ╣ ļČäņäØĒĢĀ ņłś ņ׳ņŚłļŗż. ļæÉ ĻĘĖļŻ╣ Ļ░äņØś ņŚ░ļĀ╣, ņä▒ļ│ä ļō▒ņØĆ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. ĻĘĖļ¤¼ļéś, ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”Ø ņ”ØņāüņØĖ OSDI ņĀÉņłśĻ░Ć H-PMĻĄ░ņŚÉņä£ L-PMĻĄ░ļ│┤ļŗż ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż(36.3 ┬▒ 23.2 vs. 25.3 ┬▒ 19.8). ņØ┤ņÖĆ ņāüņØæĒĢśĻ▓ī, H-PMĻĄ░ņŚÉņä£ FCSĻ░Ć ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī 1.8ļ░░ ļŹö ļåÆņĢśĻ│Ā(2.7 ┬▒ 1.2 vs. 1.6 ┬▒ 1.3), ļłłļ¼╝ ļČäļ╣äļ¤ē(ST1)ņØĆ ņ£ĀņØśĒĢśĻ▓ī ņĢĮ 45% ņżäņ¢┤ ņ׳ņŚłļŗż(4.9 ┬▒ 2.6 mm vs. 8.7 ┬▒ 4.3 mm). ĒØźļ»ĖļĪŁĻ▓īļÅä, ļłłļ¼╝ļ¦ēņØś ļČłņĢłņĀĢņä▒ņØä ļ£╗ĒĢśļŖö TFBUTļŖö ļæÉ ĻĄ░ Ļ░äņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(4.5 ┬▒ 1.8 s vs. 4.6 ┬▒ 1.5 s) (Fig. 2).
ļ│Ė ņŚ░ĻĄ¼ļŖö ļīĆĻĖ░ņśżņŚ╝ļ¼╝ņ¦ł, ĒŖ╣Ē׳ ļ»ĖņäĖļ©╝ņ¦ĆĻ░Ć ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņŚÉ ņ¢┤ļ¢ĀĒĢ£ ņśüĒ¢źņØä ņżä ņłś ņ׳ļŖöņ¦Ćļź╝ ņĢīņĢäļ│┤ņĢśļŗż. 1ļģä ņżæ ļ»ĖņäĖļ©╝ņ¦Ć PM10, PM2.5ņØś ļåŹļÅäĻ░Ć Ļ░üĻ░ü ņ¢┤ļ¢╗Ļ▓ī ļ│ĆĒĢśļŖöņ¦Ć ĻĘĖ ņČöņØ┤ļź╝ ļ©╝ņĀĆ ņé┤ĒĢĆ Ēøä, ĒÅēĻĘĀĻ░ÆņØä ĻĖ░ņżĆņ£╝ļĪ£ ļ»ĖņäĖļ©╝ņ¦ĆļåŹļÅäĻ░Ć ļåÆņØĆ ņŗ£ĻĖ░ņÖĆ ļé«ņØĆ ņŗ£ĻĖ░ ļæÉ Ļ░Ćņ¦ĆļĪ£ ĻĄ¼ļČäņØä ĒĢśņśĆļŗż. ĒÖśņ×ÉĻ░Ć ļ»ĖņäĖļ©╝ņ¦Ćļź╝ ņĀæĒĢśļ®┤ ņŗĀņ▓┤, ĒŖ╣Ē׳ ņĢłĻĄ¼Ēæ£ļ®┤ņØś ļ│ĆĒÖöĻ░Ć ņØ╝ņ¢┤ļéśļŖö ļŹ░ņŚÉļŖö ņŗ£Ļ░äņØ┤ ĒĢäņÜöĒĢĀ Ļ▓āņØ┤Ļ│Ā ļ░śļ│ĄņĀüņØĖ ļ»ĖņäĖļ©╝ņ¦ĆņØś ņśüĒ¢źņØ┤ ļłäņĀüļÉśņ¢┤ņĢ╝ ņ¢┤ļ¢ĀĒĢ£ ļ│æņĀü ņåīĻ▓¼ņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. ĻĘĖ Ļ▓░Ļ│╝, ļ»ĖņäĖļ©╝ņ¦Ć ļåŹļÅäĻ░Ć ļåÆņØĆ 1-4ņøö ļ░Å 11-12ņøö ņŗ£ĻĖ░ņŚÉļŖö ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”Ø ĒÖśņ×ÉļōżņØś ņ”ØņāüĻ│╝ ņ×äņāü ņåīĻ▓¼ļōżņØ┤ ļŹö ļéśņüśļŗżļŖö ņé¼ņŗżņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ĒĢ┤ļŗ╣ĻĖ░Ļ░äņØĆ ļåÆņØĆ ļ»ĖņäĖļ©╝ņ¦Ć ļåŹļÅäļĪ£ ņØĖĒĢ┤ ņĢłĻĄ¼Ēæ£ļ®┤ņØś ņŚ╝ņ”Ø ņåīĻ▓¼ņØ┤ ļŹö ĒÖĢņŚ░ĒĢ┤ņ¦ĆĻ│Ā ļłłļ¼╝ ņ×Éņ▓┤ņØś ļČäļ╣äļ¤ēņØ┤ ļ¦ÄņØ┤ ņżäņ¢┤ļōżņŚłņ£╝ļ®░, ļ░śļ®┤ņŚÉ ļłłļ¼╝ļ¦ēņØś ļČłņĢłņĀĢņä▒ņŚÉļŖö ļ│ĆĒÖöĻ░Ć ņŚåņŚłļŗż.
ņØ╝ļ░śņĀüņ£╝ļĪ£, ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØĆ ļłłļ¼╝ļ¦ēņØś ļČłņĢłņĀĢņä▒ņØ┤ Ļ░Ćņן ĻĖ░ļ│ĖņĀüņØĖ ĻĖ░ņĀäņØ┤ļ®░, ņŚ¼ĻĖ░ņŚÉ ļŗżņ¢æĒĢ£ ļ®öņ╗żļŗłņ”śņØ┤ ļÅÖļ░śļÉśļ®┤ņä£ ļŗżņØĖņ×Éņä▒ ņÜöņØĖņ£╝ļĪ£ ĒÖśņ×ÉļōżņØś ņĢłĻĄ¼Ēæ£ļ®┤ņŚÉ ņåÉņāüņØä ņØ╝ņ£╝Ēé©ļŗż[33]. ļłłļ¼╝ņØś ņāØņä▒ ņ×Éņ▓┤Ļ░Ć ņĀĆĒĢśļÉśļ®┤ņä£ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØ┤ ņĢģĒÖöļÉĀ ņłś ņ׳ļŖöļŹ░, ņØ┤ļŖö ņ£ĀņĀäņĀü ņÜöņØĖ, ņŚ░ļĀ╣, ņä▒ļ│ä, ĒśĖļź┤ļ¬¼ ļČłĻĘĀĒśĢ, ņĀäņŗĀ ņ¦łĒÖś(ļŗ╣ļć©, ņ×ÉĻ░Ćļ®┤ņŚŁņ¦łĒÖś), ņĮśĒāØĒŖĖ ļĀīņ”ł ņ░®ņÜ®, ļ░®ļČĆņĀ£ ĒĢ©ņ£Ā ņĢłņĢĮ ņé¼ņÜ® ļ░Å ņĢłĻ│╝ņĀü ņłśņłĀ ļō▒ņØś ļŗżņ¢æĒĢ£ ņÜöņØĖņ£╝ļĪ£ļČĆĒä░ ĻĖ░ņØĖĒĢ£ļŗż[14,34]. ĒĢ£ĒÄĖ, Ļ│╝ļÅäĒĢ£ ļłłļ¼╝ņØś ņ”Øļ░£ ņŚŁņŗ£ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņŚÉņä£ ņżæņÜöĒĢ£ ļ®öņ╗żļŗłņ”śņØĖļŹ░, ņØ┤ļĪ£ ņØĖĒĢ£ ļłłļ¼╝ ņé╝Ēł¼ņĢĢ ņ”ØĻ░ĆļŖö Ļ░ü Ļ▓░ļ¦ē ņāüĒö╝ ņäĖĒżņØś ņŚ╝ņ”Ø ļ░śņØæņØä ņØ╝ņ£╝ĒéżĻ▓ī ļÉ£ļŗż[14]. ņŚ╝ņ”Ø ļ░śņØæņØĆ TNF-╬▒, IL-6, IL-17 ļō▒ņØś ņŚ╝ņ”Ø ņØĖņ×Éļź╝ ņāØņä▒ĒĢśļÅäļĪØ ĒĢśņŚ¼ ņäĖĒż ņé¼ļ®ĖņØä ņ£ĀļÅäĒĢśĻ│Ā ļ®┤ņŚŁņäĖĒżļōżņØś ĒÖ£ņä▒ĒÖöļź╝ ņØ╝ņ£╝Ēé┤ņØĆ ļ¼╝ļĪĀ, ņĀÉņĢĪ ļČäļ╣äļź╝ Ļ░Éņåīņŗ£ņ╝£ ļłłļ¼╝ņØś ņĢłņĀĢņä▒ņŚÉ ņśüĒ¢źņØä ņŻ╝Ļ▓ī ļÉśņ¢┤ Ļ▓░ĻĄŁ ņĢģņł£ĒÖśņØä ņ£Āļ░£ĒĢ£ļŗż[35,36].
ļ»ĖņäĖļ©╝ņ¦ĆņŚÉ ņĢłĻĄ¼ Ēæ£ļ®┤ņØ┤ ļģĖņČ£ļÉ£ Ļ▓ĮņÜ░, ņŻ╝ņÜö ņŚ╝ņ”Ø ņŗĖņØ┤ĒåĀņ╣┤ņØĖņØĖ IL-1╬▓ ļ░Å TNF-╬▒ ļō▒ņØś ņāØņä▒ņ£╝ļĪ£ ņØĖĒĢśņŚ¼ ņĢłĻĄ¼Ēæ£ļ®┤ņØś ņŚ╝ņ”ØņØ┤ ņŗ¼ĒÖöļÉśĻ│Ā ņĢłĻĄ¼Ēæ£ļ®┤ņØś ņāüĒö╝ņäĖĒżļōżņŚÉ ļÅģņä▒ņØä ņØ╝ņ£╝ņ╝£ ņäĖĒżņ×Éļ®Ėņé¼ļź╝ ņ£Āļ░£ĒĢ£ļŗżļŖö Ļ▓āņØ┤ ņŚ¼ļ¤¼ ļÅÖļ¼╝ ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢśņŚ¼ ņØ┤ļ»Ė ņĀ£ņŗ£ļÉ£ ļ░öĻ░Ć ņ׳ļŗż[18,21,23]. ņØ┤ ļĢīļ¼ĖņŚÉ ļé«ņØĆ TFBUT, FCS ņ”ØĻ░ĆĻ░Ć ļéśĒāĆļéĀ ņłś ņ׳Ļ│Ā ņŻ╝Ļ┤ĆņĀüņØĖ ņĢłĻĄ¼ļČłĒÄĖĻ░ÉņØ┤ ļ░£ņāØĒĢśņŚ¼ ļåÆņØĆ OSDIņØś Ļ▓░Ļ│╝ļź╝ Ļ░ĆņĀĖņś©ļŗż. ļśÉĒĢ£, ĻĄŁļé┤ ņĀäĒ¢źņĀü ņŚ░ĻĄ¼ņŚÉņä£ PM10ņØĆ ļłłļ¼╝ļ¦ēņØś ņĢłņĀĢņä▒ļ¦īņØä ņĀĆĒĢśņŗ£ĒéżĻ│Ā, PM2.5ļŖö ņĢłĻĄ¼ ļČłĒÄĖĻ░ÉĻ│╝ ļłłļ¼╝ ļČäļ╣äļź╝ ņ”ØĻ░Ćņŗ£ņ╝░ņ£╝ļ®░, Ļ░üĻ░üņØś ļīĆĻĖ░ ņśżņŚ╝ļ¼╝ņ¦łņØ┤ ļŗżļźĖ ņ×æņÜ® ļ®öņ╗żļŗłņ”śņØä ĒåĄĒĢ┤ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØä ņĢģĒÖöņŗ£Ēé¼ ņłś ņ׳ļŗżļŖö ņĀÉļÅä ņĢīļĀżņĀĖ ņ׳ļŗż[37]. ST1ņØś Ļ░ÉņåīļŖö ļłłļ¼╝ņāśņØś ĻĖ░ļŖźņĀĆĒĢś ļśÉļŖö ņŚ╝ņ”ØņØ┤ ņøÉņØĖņØ╝ ņłś ņ׳ļŖöļŹ░ ļ¦łņ╣ś ņć╝ĻĘĖļĀī ņ”ØĒøäĻĄ░ņ▓śļ¤╝ ņĀäņŗĀņØś ņŚ╝ņ”Øļ░śņØæņØ┤ ļłłļ¼╝ņāśņŚÉļÅä ņĢģņśüĒ¢źņØä ļ»Ėņ│É ĻĘĖ ĻĖ░ļŖźņØ┤ ļ¢©ņ¢┤ņ¦ĆļŖö Ļ▓āņ£╝ļĪ£ļÅä ņāØĻ░üĒĢ┤ļ│╝ ņłś ņ׳ļŗż. ļ░śļ│ĄņĀüņ£╝ļĪ£ ļåÆņØĆ ļåŹļÅäņØś ļ»ĖņäĖļ©╝ņ¦ĆņŚÉ ļģĖņČ£ļÉĀ Ļ▓ĮņÜ░ ņĢ×ņä£ ņ¢ĖĻĖēĒĢ£ ņĀäņŗĀ ņŚ╝ņ”Ø ļ®öņ╗żļŗłņ”śņØ┤ ļ░£ņāØĒĢśņŚ¼ ļ¦īņä▒ņĀüņØĖ ņĢłĻĄ¼ Ēæ£ļ®┤ ņŚ╝ņ”ØņØ┤ ļ░£ņāØĒĢśĻ│Ā ļłłļ¼╝ņāśņØś ņŚ╝ņ”Øņ£╝ļĪ£ ļłłļ¼╝ņāØņä▒ņŚÉ ņśüĒ¢źņØä ļ░øņĢä H-PMĻĄ░Ļ│╝ L-PMĻĄ░ ļæÉ ĻĄ░ņŚÉņä£ ņ£ĀņØśĒĢ£ FCS, ST1 ņ░©ņØ┤ļź╝ ņ£Āļ░£ĒĢĀ ņłś ņ׳ņØä Ļ▓āņØ┤ļØ╝Ļ│Ā ņāØĻ░üļÉ£ļŗż. ļłłļ¼╝ļ¦ēņØś ļČłņĢłņĀĢņä▒ņØä ļéśĒāĆļé┤ļŖö TFBUTļŖö ļ»ĖņäĖļ©╝ņ¦Ć ļģĖņČ£ņŚÉ ņØśĒĢ┤ ņśüĒ¢źņØä ļ░øņ£╝ļéś ļåŹļÅäņŚÉ ļö░ļźĖ ņ░©ņØ┤ļŖö ļŗżļźĖ ņ¦ĆĒæ£ļōżņŚÉ ļ╣äĒĢ┤ ņāüļīĆņĀüņ£╝ļĪ£ ņĀüļŗżĻ│Ā ņāØĻ░üĒĢ┤ļ│╝ ņłś ņ׳ļŗż.
ļ»ĖņäĖļ©╝ņ¦ĆĻ░Ć ņÜ░ļ”¼ ļ¬ĖņŚÉ ņ╣©Ēł¼ĒĢśļ®┤ Ļ░ĢņĀ£ļĪ£ ļ░░ņČ£ĒĢĀ ļ░®ļ▓ĢņØ┤ ņŚåņ¢┤ ņ¢ĖņĀ£ ņ¢┤ļ¢ż ļ¼ĖņĀ£Ļ░Ć ļ░£ņāØĒĢĀņ¦Ć ņĀĢĒÖĢĒ׳ ņĢīņ¦Ć ļ¬╗ĒĢ£ ņ▒ä ĒÅēņāØ ņé┤ņĢäĻ░ĆņĢ╝ ĒĢ£ļŗżļŖö ļŹ░ Ēü░ ļ¼ĖņĀ£Ļ░Ć ņ׳ļŗż[3,6,8]. ļśÉĒĢ£ ņ▓┤ļé┤ ņä¼ļ¬©ņŚÉņä£ ņŚ¼Ļ│╝ļÉśņ¦Ć ņĢŖņØĆ ņ▒ä ņŗĀņ▓┤ Ļ░ü ĻĖ░Ļ┤ĆņŚÉ ņ¦üņĀæ ļÅäļŗ¼ĒĢĀ ņłś ņ׳Ļ│Ā ĒÅÉĒżļź╝ ĒåĄĻ│╝ĒĢ┤ ĒśłĻ┤ĆņŚÉ ņ╣©Ēł¼ĒĢśĻĖ░ļÅä ĒĢ£ļŗż. ņØ┤ļĀćĻ▓ī ņŗĀņ▓┤ Ļ░ü ĻĖ░Ļ┤ĆņŚÉ ļÅäļŗ¼ĒĢ£ ļ»ĖņäĖļ©╝ņ¦ĆĻ░Ć ņŚ╝ņ”Ø ļ░śņØæņØä ņØ╝ņ£╝ņ╝£ ņŗ¼ņןņ¦łĒÖśĻ│╝ ĒśĖĒØĪĻĖ░ ņ¦łļ│æņØä ļ░£ņāØņŗ£Ēé©ļŗżļŖö Ļ▓āņØĆ ņØ┤ļ»Ė ņל ņĢīļĀżņĀĖ ņ׳ļŗż[9,21].
ļīĆĻĖ░ņśżņŚ╝ļ¼╝ņ¦łĻ│╝ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØś Ļ┤ĆĻ│äņŚÉ ļīĆĒĢ┤ņä£ļŖö ļ¦ÄņØ┤ ņĢīļĀżņĀĖ ņ׳ņ¦Ć ņĢŖņ£╝ļéś, ņŚ░ĻĄ¼ņ×Éļōżļ¦łļŗż Ļ▓¼ĒĢ┤Ļ░Ć ņĢĮĻ░äņö® ļŗżļź┤ļŗż. ņÜ░ļ”¼ļéśļØ╝ņŚÉņä£ ņŗ£Ē¢ēĒĢśņśĆļŹś Hwang et al [30]ņØś ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤, ļåÆņØĆ O3 ļĀłļ▓©Ļ│╝ ļé«ņØĆ ņŖĄļÅäĻ░Ć ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”Ø ņ£Āļ│æļźĀĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖö ļ░śļ®┤ PM10 ļĀłļ▓©ņØĆ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØĻ│╝ ĒåĄĻ│äĒĢÖņĀüņ£╝ļĪ£ Ļ┤ĆļĀ©ņØ┤ ņŚåņŚłļŗż. ņĀĆņ×ÉļōżņØĆ 2010ļģäļČĆĒä░ 2012ļģäĻ╣īņ¦Ć ņ¦äĒ¢ēļÉ£ ĻĄŁļ»╝Ļ▒┤Ļ░Ģ ņśüņ¢æņĪ░ņé¼ ņäżļ¼ĖņØä ĒåĄĒĢ┤ ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ļź╝ ņ¦äĒ¢ēĒĢśņśĆļŖöļŹ░, ņŗżņĀ£ ņĢłĻĄ¼Ēæ£ļ®┤ Ļ┤ĆļĀ© ņ×äņāü ļŹ░ņØ┤Ēä░ļź╝ ņé¼ņÜ®ĒĢśņ¦Ć ņĢŖĻ│Ā ņäżļ¼Ėņ×ÉļŻīļź╝ ņØ┤ņÜ®ĒĢ£ ņĀÉ, ļ»ĖņäĖļ©╝ņ¦Ć ļåŹļÅäļź╝ ņäĖļČĆ ĻĖ░Ļ░ä ļ│äļĪ£ ļČäņäØĒĢśņ¦Ć ņĢŖņØĆ ņĀÉ ļō▒ņŚÉņä£ ļ│Ė ņŚ░ĻĄ¼ņÖĆ ņ░©ņØ┤Ļ░Ć ņ׳ļŗż. ņżæĻĄŁņØś ļīĆĻĘ£ļ¬© ņŚ░ĻĄ¼ņŚÉņä£ļŖö O3, PM2.5 ļ░Å SO2ļź╝ ĒżĒĢ©ĒĢ£ ļīĆĻĖ░ ņśżņŚ╝ ļ¼╝ņ¦łņØĆ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØś ņ£äĒŚś ņÜöņåīņśĆņ£╝ļ®░ PM10 ļ░Å NO2ņÖĆļŖö ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņŚåņŚłļŹś ļ░śļ®┤, COļŖö ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØś ņ×Āņ×¼ņĀüņØĖ ļ│┤ĒśĖņÜöņåīņØ╝ ņłś ņ׳ļŗżĻ│Ā ĒĢśņśĆļŗż[15,27]. ļśÉĒĢ£, ņĄ£ĻĘ╝ņŚÉ ņŗ£Ē¢ēļÉ£ ļ®öĒāĆļČäņäØ ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤, ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņŚÉļŖö NO2 ļ░Å SOĻ░Ć ņśüĒ¢źņØä ļ»Ėņ╣śļŖö ļ░śļ®┤ PM10 ļĀłļ▓©ņØĆ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØ┤ ņĀüļŗżļŖö ļ│┤Ļ│ĀļÅä ņ׳ņŚłņ£╝ļéś, ļČäņäØņŚÉ ņé¼ņÜ®ļÉ£ 19Ļ░£ņØś ņŚ░ĻĄ¼ ņżæ 15Ļ░£ļŖö ļŗ©ņØ╝ ĻĘĖļŻ╣ ņŚ░ĻĄ¼ņØ┤ļ®░, PM10ņØä ņĀ£ņÖĖĒĢ£ ļŗżļźĖ ļ¼╝ņ¦łļōżņŚÉ ļīĆĒĢ┤ņä£ļŖö ņżæĻ░ä ņĀĢļÅäņØś ņŗĀļó░ļÅäļ¦īņØä Ļ░¢Ļ│Ā ņ׳ņŚłĻ│Ā, ņŚ░ĻĄ¼ļōż Ļ░äņØś ļīĆĻĖ░ņśżņŚ╝ ļ¼╝ņ¦łņØś ļģĖņČ£ņŚÉ ļīĆĒĢ£ ĒÅēĻ░Ćļ░®ļ▓ĢņØś ņ░©ņØ┤ņÖĆ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņŚÉ ļīĆĒĢ£ ņĀĢņØśĻ░Ć ņØ╝Ļ┤ĆļÉśņ¦Ć ņĢŖļŖö ĒĢ£Ļ│äļź╝ ļ│┤ņśĆļŗż[38]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ»ĖņäĖļ©╝ņ¦ĆĻ░Ć ļåÆņØĆ ņŗ£ĻĖ░ņŚÉļŖö ĒÖśņ×ÉņØś ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØś ņ¢æņāüņØ┤ ļŹö ņŗ¼ĒĢ£ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ņ£╝ļéś, ņØĖĻ│╝Ļ┤ĆĻ│äļź╝ ļ░ØĒ׳ļĀżļ®┤ ļÅÖņØ╝ĒĢ£ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”Ø ņĢĮņĀ£ļź╝ ņé¼ņÜ®ĒĢśļŖö ļŹö ļ¦ÄņØĆ ņłśņØś ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņŚÉ ņśüĒ¢źņØä ņżä ņłś ņ׳ļŖö ņŚ¼ļ¤¼Ļ░Ćņ¦Ć ĒÖśĻ▓ĮņĀüņØĖ ņÜöņØĖļōżņØ┤ ņ▓ĀņĀĆĒ׳ ĒåĄņĀ£ļÉ£ ņāüĒÖ®ņŚÉņä£ ļ»ĖņäĖļ©╝ņ¦Ć ļåŹļÅäņŚÉ ļö░ļØ╝ ņ¢┤ļ¢╗Ļ▓ī ļ│ĆĒÖöĒĢśļŖöņ¦Ćļź╝ ļČäņäØĒĢśļŖö ņĀäĒ¢źņĀü ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.
ņŻ╝ļĪ£ ļ┤äĻ│╝ Ļ▓©ņÜĖņŚÉ ļ»ĖņäĖļ©╝ņ¦ĆņØś ļåŹļÅäĻ░Ć ļåÆņĢśļŖöļŹ░(H-PM: 1-4ņøö ļ░Å 11, 12ņøö), ņÜ░ņäĀ ļ┤äņŚÉļŖö ņØ┤ļÅÖņä▒ ņĀĆĻĖ░ņĢĢĻ│╝ Ļ▒┤ņĪ░ĒĢ£ ņ¦ĆĒæ£ļ®┤ņØś ņśüĒ¢źņ£╝ļĪ£ ĒÖ®ņé¼ļź╝ ļÅÖļ░śĒĢ£ Ļ│ĀļåŹļÅä ļ»ĖņäĖļ©╝ņ¦ĆĻ░Ć ļ░£ņāØĒĢĀ Ļ░ĆļŖźņä▒ņØ┤ Ēü¼ļŗż. ļé£ļ░® ļō▒ ņŚ░ļŻī ņé¼ņÜ®ņØ┤ ņ”ØĻ░ĆĒĢśļŖö Ļ▓©ņÜĖņØ┤ļ®┤ ļ»ĖņäĖļ©╝ņ¦Ć ļåŹļÅäĻ░Ć ļåÆņĢäņ¦ł ņłś ņ׳ļŗż. ļ░śļ®┤, ņŚ¼ļ”äĻ│╝ Ļ░ĆņØäņŚÉļŖö ļ»ĖņäĖļ©╝ņ¦ĆņØś ļåŹļÅäĻ░Ć ļé«ņĢśļŖöļŹ░(L-PM: 5-10ņøö) ņŚ¼ļ”äņŚÉļŖö ļ╣äĻ░Ć ņ×ÉņŻ╝ ļé┤ļ”¼ļ»ĆļĪ£ ļ»ĖņäĖļ©╝ņ¦ĆņÖĆ Ļ░ÖņØĆ ļīĆĻĖ░ņśżņŚ╝ļ¼╝ņ¦łņØ┤ ļ╣Śļ░®ņÜĖņŚÉ ņö╗Ļ▓© ņĀ£Ļ▒░ļÉ£ļŗż. Ļ░ĆņØäņØĆ ļŗżļźĖ Ļ│äņĀłņŚÉ ļ╣äĒĢ┤ ĻĖ░ņĢĢĻ│äņØś ĒØÉļ”äņØ┤ ļ╣Āļź┤Ļ│Ā ņ¦ĆņŚŁņĀüņØĖ ļīĆĻĖ░ņØś ņł£ĒÖśņØ┤ ņøÉĒÖ£ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ļ»ĖņäĖļ©╝ņ¦Ć ļåŹļÅäĻ░Ć ļé«ļŗż. ņØ┤ļź╝ ņżäņØ┤ĻĖ░ ņ£äĒĢ┤ņä£ ĒĢĀ ņłś ņ׳ļŖö ĻĄŁļé┤ņØś ļģĖļĀźņØĆ ņé¼ņŚģņן Ļ░Éņŗ£, Ļ▓Įņ£Āņ░© ņĀ£ĒĢ£, Ļ░ĆņČĢļČäļć© ļō▒ Ļ░Éņŗ£ ļō▒ņØ┤ ņ׳Ļ▓Āļŗż. ļśÉĒĢ£ ņāüļīĆ ņŖĄļÅäņŚÉ ļö░ļźĖ ļ»ĖņäĖļ©╝ņ¦Ć ļåŹļÅä ļ│ĆĒÖöļÅä ļ░£ņāØ Ļ░ĆļŖźĒĢśļ»ĆļĪ£ ņØ┤ ņŚŁņŗ£ Ļ│ĀļĀżļÉśņ¢┤ņĢ╝ ĒĢ£ļŗż.
ļ│Ė ņŚ░ĻĄ¼ņØś ņĀ£ĒĢ£ņĀÉņØĆ ļŗżņØīĻ│╝ Ļ░Öļŗż. ņ▓½ņ¦ĖļĪ£, ĒĢ£ ļ¬ģ ĒĢ£ ļ¬ģņØś ĒÖśņ×ÉņŚÉņä£ ņŗ£Ļ░äņŚÉ ļö░ļØ╝ Ļ░üĻ░üņØś ņŗ£ĻĖ░ļ│ä ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØś ņāüĒā£ļź╝ ņóģņĀüņ£╝ļĪ£ ņé┤ĒÄ┤ļ│┤ļŖö Ļ▓āņØ┤ ļ»ĖņäĖļ©╝ņ¦Ć ļåŹļÅäņÖĆ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”Ø Ļ░äņØś ņØĖĻ│╝Ļ┤ĆĻ│äļź╝ ĒīīņĢģĒĢĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉśļéś, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ņØś ĒŖ╣ņä▒ņāü Ļ░ü ņŗ£ĻĖ░ņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö ņŚ¼ļ¤¼ ĒÖśņ×ÉļōżņØś ņ×äņāüņ¢æņāüņØä ĒĢ®ņ│Éņä£ ļČäņäØĒĢśņśĆļŗż. ļö░ļØ╝ņä£, ņØĖĻ│╝Ļ┤ĆĻ│ä ĒÖĢņØĖņŚÉ ļīĆĒĢ┤ ņĀ£ĒĢ£ņĀüņØ╝ ļ┐Éļ¦ī ņĢäļŗłļØ╝, ņĢłĻĄ¼Ēæ£ļ®┤ņ¦łĒÖśņŚÉ ļ»ĖņäĖļ©╝ņ¦ĆņØś ņŗ£ĻĖ░ļ│ä ĒÅēĻĘĀĻ░Æļ¦īņØä Ļ│ĀļĀżĒĢśĻ│Ā ĒŖ╣ņĀĢ ņŗ£ĻĖ░ ņĢłņØś Ļ│ĀļåŹļÅäņŚÉ Ēö╝ņåīļō£Ļ░Ć ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ļ░śņśüĒĢśņ¦Ć ļ¬╗ĒĢ£ ĒĢ£Ļ│äĻ░Ć ņ׳ļŗż. ļæśņ¦ĖļĪ£, ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØś ņ×äņāüņ¦ĆĒæ£ļōżņØä ņóĆļŹö ļŗżņ¢æĒĢśĻ│Ā ļ¦ÄņØĆ Ļ▓āņØä ĒżĒĢ©ĒĢśņŚ¼ ĒĢ©Ļ╗ś ļČäņäØĒĢśņ¦Ć ļ¬╗Ē¢łļŗżļŖö ļŗ©ņĀÉņØ┤ ņ׳ļŗż. ņŗżņĀ£ļĪ£ ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØĆ ļŗżņØĖņ×É ņ¦łĒÖśņØ┤ļ®░, ļ¦łņØ┤ļ┤äņāś ĻĖ░ļŖźņןņĢĀ ļō▒ņØ┤ ļÅÖļ░śļÉśĻ▒░ļéś ņŻ╝ ĻĖ░ņĀäņØ╝ ņłś ņ׳ļŗż. ņģŗņ¦ĖļĪ£, ņäĀĒ¢ēņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ņāüļīĆ ņŖĄļÅä ņ×Éņ▓┤Ļ░Ć ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņŚÉ ņśüĒ¢źņØä ņżä ņłś ņ׳ņ£╝ļ®░[39] ļ»ĖņäĖļ©╝ņ¦Ć ļåŹļÅäņŚÉļÅä ņśüĒ¢źņØä ņżä ņłś ņ׳ņ£╝ļéś ļ»ĖņäĖļ©╝ņ¦Ć ļåŹļÅäņ▓śļ¤╝ ņŖĄļÅäņĖĪņĀĢņØ┤ ņ¦ĆņŚŁļ│äļĪ£ ņäĖļČĆņĀüņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦Ćņ¦Ć ņĢŖņĢä ļ│┤ņĀĢĒĢĀ ņłś ņŚåņŚłļŹś ĒĢ£Ļ│äĻ░Ć ņ׳ņŚłļŗż. ļśÉĒĢ£, ĻĖ░ņś© ļ░Å ņĢīļ¤¼ņĀĀņØś ņ¢æ, Ļ▓©ņÜĖņ▓Ā ļé£ļ░®ņ£╝ļĪ£ ņØĖĒĢ£ ņŗżļé┤ņÖĆ ņŗżņÖĖņØś ņŖĄļÅä ņ░©ņØ┤ļÅä ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņŚÉ ņśüĒ¢źņØä ņżä ņłś ņ׳ņ£╝ļéś ĒÖśĻ▓ĮņĀü ļ│ĆņłśļōżņŚÉ ļīĆĒĢ£ Ļ░ØĻ┤ĆņĀüņØĖ ļŹ░ņØ┤Ēä░ļź╝ ņ¢╗ļŖö Ļ▓āņØ┤ ņĀ£ĒĢ£ņĀüņØ┤ņ¢┤ņä£ ļ░░ņĀ£ļÉśņ¦Ć ļ¬╗ĒĢ£ņĀÉņØä ļōż ņłś ņ׳ļŗż. ļäĘņ¦ĖļĪ£, Ļ░ü ļīĆĻĖ░ņśżņŚ╝ļ¼╝ņ¦łņØś ņĢłĻĄ¼Ēæ£ļ®┤ņŚÉ ņśüĒ¢źņØ┤ ļ»Ėņ╣śļŖö ņĀÉņØ┤ ņä£ļĪ£ ļŗżļźĖ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśļéś, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņśżņ¦ü ļ»ĖņäĖļ©╝ņ¦Ćļ¦īņØä ĻĖ░ņżĆņ£╝ļĪ£ Ļ│ĀļåŹļÅä ļģĖņČ£ĻĄ░Ļ│╝ ņĀĆļåŹļÅä ļģĖņČ£ĻĄ░ņ£╝ļĪ£ ļČäļźśļź╝ ĒĢśņśĆņ£╝ļ®░, Ļ░ü ļīĆĻĖ░ņśżņŚ╝ļ¼╝ņ¦łņØś ņśüĒ¢źņØä ļ│┤ņĀĢĒĢśņ¦Ć ņĢŖņØĆ ĒĢ£Ļ│äĻ░Ć ņ׳ļŗż[37]. ļ¦łņ¦Ćļ¦ēņ£╝ļĪ£ ņóĆļŹö ļ¦ÄņØĆ ņłśņØś ĒÖśņ×ÉļōżņØä ņŚ░ĻĄ¼ņŚÉ ĒżĒĢ©ĒĢ£ļŗżļ®┤ ĒĢśņ£äļČäņäØņØä ļŗżņ¢æĒĢśĻ▓ī ĒĢĀ ņłś ņ׳ņ£╝ļ»ĆļĪ£ ņČöĒøä ņ¦ĆņåŹņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.
ļłłņØĆ ņÖĖļČĆ ņäĖĻ│äņÖĆ ņ¦üņĀæ ņĀæņ┤ēĒĢśļ»ĆļĪ£ ņŻ╝ļ│Ć ļīĆĻĖ░ĒÖśĻ▓ĮņØś ļ│ĆĒÖöļŖö ņĢłĻĄ¼Ēæ£ļ®┤ņŚÉ ļ¦żņÜ░ Ēü░ ņśüĒ¢źņØä ļ»Ėņ╣£ļŗż. ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØĆ ļ¦żņÜ░ ĒØöĒĢ£ ņĢłĻĄ¼Ēæ£ļ®┤ ņ¦łĒÖśņØĖļŹ░, ļ»ĖņäĖļ©╝ņ¦Ć ļō▒ ļīĆĻĖ░ņśżņŚ╝ļ¼╝ņ¦łņØ┤ ņŚ╝ņ”ØņØä ņ£Āļ░£ĒĢśĻ│Ā ļłłļ¼╝ļ¤ēņØä Ļ░Éņåīņŗ£ĒéżļŖö ļō▒ņØś ņ×æņÜ®ņØä ĒĢśņŚ¼ ļ»ĖņäĖļ©╝ņ¦ĆĻ░Ć ļåÆņØĆ ņŗ£ĻĖ░ņŚÉļŖö ĒÖśņ×ÉļōżņØś ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”ØņØ┤ ņĢģĒÖöļÉĀ ņłś ņ׳Ļ│Ā, ļö░ļØ╝ņä£ Ļ░ü ņŗ£ĻĖ░ļ│äļĪ£ ņ╣śļŻīņØś ņĀĢļÅäļéś Ļ▓ĮĻ│╝Ļ┤Ćņ░░ ĻĖ░Ļ░äņØä ļŗ¼ļ”¼ĒĢśļŖö ļō▒ņØś ļŗżļźĖ ņĀæĻĘ╝ņØ┤ ĒĢäņÜöĒĢ£ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśļ®░ ĻĄŁĻ░ĆņĀüņØĖ ņ░©ņøÉņŚÉņä£ļŖö ļīĆĻĖ░ņśżņŚ╝ļ¼╝ņ¦łņØä ņżäņØ┤ļĀżļŖö ļģĖļĀźņØ┤ ĒĢäņÜöĒĢśļŗż.
Notes
This research was supported by the research grant of National Health Insurance Service Ilsan and by the faculty research grant of Yonsei University College of Medicine (No. 6-2021-0117).
Figure┬Ā1.
Monthly variations in ambient air pollutant concentrations in the year 2018. (A) Ambient particulate matter (PM) with aerodynamic diameter Ōēż 10 ╬╝m (PM10) and Ōēż 2.5 ╬╝m (PM2.5). The box indicates the period with low concentration of ambient PM based on the mean concentration. (B) Carbon monoxide (CO), ozone (O3), nitrogen dioxide (NO2), and sulfur dioxide (SO2). All air pollutant concentrations were measured in Goyang-si, Paju-si, Gimpo-si (Gyeonggi-do) and Eunpyeoung-gu (Seoul).
Figure┬Ā2.
Comparison of clinical signs and symptoms between subgroups of dry eye patients in the year 2018. ns = not significant; OSDI = ocular surface disease index; L-PM = subgroup of dry eye patients with exposure to low concentration of ambient particulate matter; H-PM = subgroup of dry eye patients with exposure to high concentration of ambient particulate matter. p-values for comparisons between groups were determined with Mann-Whitney test. **p < 0.01.

Table┬Ā1.
Demographics and clinical indexes of patients with dry eye disease
Table┬Ā2.
Monthly concentrations of air pollutants and relative humidity in the year 2018
Table┬Ā3.
Comparisons of clinical parameters among subgroups of dry eye patients according to exposure to low or high concentrations of ambient particulate matter
Values are presented as mean ┬▒ standard deviation (median, range) or number (%).
L-PM = subgroup of dry eye patients with exposure to low concentration of ambient particulate matter; H-PM = subgroup of dry eye patients with exposure to high concentration of ambient particulate matter; TFBUT = tear film breakup time; OSDI = Ocular Surface Disease Index; NO2 = nitrogen dioxide; O3 = ozone; CO = carbon monoxide; SO2 = sulfur dioxide; ns = not significant.
p-values for comparisons between groups were determined with Mann-Whitney test.
REFERENCES
1) Kim KH, Kabir E, Kabir S. A review on the human health impact of airborne particulate matter. Environ Int 2015;74:136-43.


2) Wu W, Jin Y, Carlsten C. Inflammatory health effects of indoor and outdoor particulate matter. J Allergy Clin Immunol 2018;141:833-44.


3) Thompson JE. Airborne particulate matter: human exposure and health effects. J Occup Environ Med 2018;60:392-423.

4) Zhang Z, Chai P, Wang J, et al. Association of particulate matter air pollution and hospital visits for respiratory diseases: a time-series study from China. Environ Sci Pollut Res Int 2019;26:12280-7.


5) Yang Y, Ruan Z, Wang X, et al. Short-term and long-term exposures to fine particulate matter constituents and health: a systematic review and meta-analysis. Environ Pollut 2019;247:874-82.


6) Schmidt S. Particulate matter and cognition: using brain imaging to study impacts of air pollution. Environ Health Perspect 2018;126:064003.



7) Cai J, Yu S, Pei Y, et al. Association between airborne fine particulate matter and residents' cardiovascular diseases, ischemic heart disease and cerebral vascular disease mortality in areas with lighter air pollution in China. Int J Environ Res Public Health 2018;15:1918.



8) Karakatsani A, Analitis A, Perifanou D, et al. Particulate matter air pollution and respiratory symptoms in individuals having either asthma or chronic obstructive pulmonary disease: a European multicentre panel study. Environ Health 2012;11:75.



9) Barrett JR. Particulate matter and cardiovascular disease: researchers turn an eye toward microvascular changes. Environ Health Perspect 2013;121:A282.



10) Craig JP, Nelson JD, Azar DT, et al. TFOS DEWS II report executive summary. Ocul Surf 2017;15:802-12.


11) Tsubota K, Yokoi N, Shimazaki J, et al; Asia Dry Eye Society. New perspectives on dry eye definition and diagnosis: a consensus report by the Asia Dry Eye Society. Ocul Surf 2017;15:65-76.

12) Jung JH, Ji YW, Hwang HS, et al. Proteomic analysis of human lacrimal and tear fluid in dry eye disease. Sci Rep 2017;7:13363.



13) Stapleton F, Alves M, Bunya VY, et al. TFOS DEWS II epidemiology report. Ocul Surf 2017;15:334-65.


14) Bron AJ, de Paiva CS, Chauhan SK, et al. TFOS DEWS II pathophysiology report. Ocul Surf 2017;15:438-510.


15) Cui YH, Hu ZX, Gao ZX, et al. Airborne particulate matter impairs corneal epithelial cells migration via disturbing FAK/RhoA signaling pathway and cytoskeleton organization. Nanotoxicology 2018;12:312-24.


16) Gao ZX, Song XL, Li SS, et al. Assessment of DNA damage and cell senescence in corneal epithelial cells exposed to airborne particulate matter (PM2.5) collected in Guangzhou, China. Invest Ophthalmol Vis Sci 2016;57:3093-102.


17) Fu Q, Lyu D, Zhang L, et al. Airborne particulate matter (PM2.5) triggers autophagy in human corneal epithelial cell line. Environ Pollut 2017;227:314-22.


18) Yang Q, Li K, Li D, Zhang Y, Liu X, Wu K. Effects of fine particulate matter on the ocular surface: An in vitro and in vivo study. Biomed Pharmacother 2019;117:109177.


19) Tang YJ, Chang HH, Chiang CY, et al. A murine model of acute allergic conjunctivitis induced by continuous exposure to particulate matter 2.5. Invest Ophthalmol Vis Sci 2019;60:2118-26.


20) Lee TG, Hyun SW, Jo K, et al. Achyranthis radix extract improves urban particulate matter-induced dry eye disease. Int J Environ Res Public Health 2019;16:3229.



21) Tan G, Li J, Yang Q, et al. Air pollutant particulate matter 2.5 induces dry eye syndrome in mice. Sci Rep 2018;8:17828.



22) Li J, Tan G, Ding X, et al. A mouse dry eye model induced by topical administration of the air pollutant particulate matter 10. Biomed Pharmacother 2017;96:524-34.


23) Song P, Chang X, Wang M, An L. Variations of pterygium prevalence by age, gender and geographic characteristics in China: A systematic review and meta-analysis. PLoS One 2017;12:e0174587.



24) Kim S, Park H, Park H, Joung B, Kim E. The acute respiratory exposure by intratracheal instillation of Sprague-Dawley rats with diesel particulate matter induces retinal thickening. Cutan Ocul Toxicol 2016;35:275-80.


25) Lee JY, Kim JW, Kim EJ, Lee MY, Nam CW, Chung IS. Spatial analysis between particulate matter and emergency room visits for conjunctivitis and keratitis. Ann Occup Environ Med 2018;30:41.



26) Mimura T, Ichinose T, Yamagami S, et al. Airborne particulate matter (PM2.5) and the prevalence of allergic conjunctivitis in Japan. Sci Total Environ 2014;487:493-9.


27) Yu D, Deng Q, Wang J, et al. Air pollutants are associated with dry eye disease in urban ophthalmic outpatients: a prevalence study in China. J Transl Med 2019;17:46.



28) Chang CJ, Yang HH, Chang CA, Tsai HY. Relationship between air pollution and outpatient visits for nonspecific conjunctivitis. Invest Ophthalmol Vis Sci 2012;53:429-33.


29) Um SB, Kim NH, Lee HK, Song JS, Kim HC. Spatial epidemiology of dry eye disease: findings from South Korea. Int J Health Geogr 2014;13:31.



30) Hwang SH, Choi YH, Paik HJ, et al. Potential importance of ozone in the association between outdoor air pollution and dry eye disease in South Korea. JAMA Ophthalmol 2016;134:503-10.


31) Wolffsohn JS, Arita R, Chalmers R, et al. TFOS DEWS II diagnostic methodology report. Ocul Surf 2017;15:539-74.


32) Bron AJ, Evans VE, Smith JA. Grading of corneal and conjunctival staining in the context of other dry eye tests. Cornea 2003;22:640-50.


33) Craig JP, Nichols KK, Akpek EK, et al. TFOS DEWS II definition and classification report. Ocul Surf 2017;15:276-83.


34) Sullivan DA, Rocha EM, Aragona P, et al. TFOS DEWS II sex, gender, and hormones report. Ocul Surf 2017;15:284-333.


35) Ji Ji YW, Seo Y, Choi W, et al. Dry eye-induced CCR7+CD11b+ cell lymph node homing is induced by COX-2 activities. Invest Ophthalmol Vis Sci 2014;55:6829-38.


36) Ji YW, Mittal SK, Hwang HS, et al. Lacrimal gland-derived IL-22 regulates IL-17-mediated ocular mucosal inflammation. Mucosal Immunol 2017;10:1202-10.



37) Kim Y, Choi YH, Kim MK, Paik HJ, Kim DH. Different adverse effects of air pollutants on dry eye disease: Ozone, PM2.5, and PM10. Environ Pollut 2020;265(Pt B):115039.





 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print