|
 |
| Ann Optom Contact Lens > Volume 21(3); 2022 > Article |
|
Abstract
ëȘ©ì
ëČ ìČŽíž íŹëë§ìŒ íììì ìëŹëŠŹëŹŽë§ ìčëŁë„Œ ìíí í êŽê°íêŽìì íêŽìĄ°ìì ì í”íŽ ìčëŁíšêłŒë„Œ ë¶ìíŽëłŽêł ì íë€.
ëìêłŒ ë°©ëČ
ëČ ìČŽížëłìŒëĄ ì§ëšë°êł , ìĄ°ì ëì§ ìë íŹëë§ìŒìŒëĄ ìëŹëŠŹëŹŽë§ ìčëŁë„Œ ììíìŹ 30ìŁŒ ìŽì êČœêłŒ êŽì°°íìë 17ëȘ
ì íìì 32ìì ëíŽ íí„ì ìëŹŽêž°ëĄ ë¶ìì ìííìë€. êŽê°íêŽìì íêŽìĄ°ìì ì í”íŽ ìì êČœì ë íêŽëì¶, ë§ë§ì 맄 íêŽëì¶, ëȘšìžíêŽ íêŽëì¶ ë±ìŒëĄ ëëìŽ íŹëë§ìŒì ìíë„Œ íê°íêł , íêŽëì¶ì ì€ìŹë¶ì ìŁŒëłë¶ëĄ ëëìŽ ìëŹëŠŹëŹŽë§ ìčëŁ ìì ìŽí 30ìŁŒêčì§ì ìčëŁ ë°ìì íê°íìë€.
êČ°êłŒ
ìëŹëŠŹëŹŽë§ ìčëŁ ìí í íìë€ì ì”ëê”ì ìë „êłŒ ìŽêŽê°íêŽìì íêŽìĄ°ìì ì ìë 6ìŁŒ, 14ìŁŒ, 30ìŁŒ ëȘšëìì ì ìí ê°ìë„Œ 볎ìë€. íêŽëì¶ì êČœì° ìëŹëŠŹëŹŽë§ ìčëŁ ìì ì êłŒ ëčê”íìŹ ìčëŁ ìì í 30ìŁŒì§ž ë§ë§ì ë§„êłŒ ëȘšìžíêŽì íêŽëì¶ì íì í ì€ììŒë(p = 0.032, p = 0.004), ìì êČœì ë êłŒíêŽì ìëì ìŒëĄ ì§ìëìë€(p = 0.083). ê° êČœêłŒ êŽì°° ìêž°ë§ë€ ì€ìŹë¶ ë§ë§íêŽ íêŽëì¶ì ì ìí ê°ìê° ìììŒë, ìŁŒëłë¶ ë§ë§íêŽ íêŽëì¶ì êČœì° 0-6ìŁŒ, 6-14ìŁŒ, 14-30ìŁŒ êž°ê° ëì ì ìí ëłíë ììë€.
Abstract
Purpose
To investigate the role of ultra-widefield fluorescein angiography (UWFA) for monitoring the therapeutic response to adalimumab in patients with Behcetâs uveitis.
Methods
Patients with Behcetâs uveitis treated with adalimumab for â„ 30 weeks were included. The best-corrected visual acuity (BCVA), grading of anterior chamber cell, grading of vitreous haze, and UWFA findings were assessed at baseline, and at 6, 14, and 30 weeks from the start of adalimumab treatment.
Results
A total of 32 eyes of 17 patients were included. There were significant decreases in BCVA and UWFA scores at 6, 14, and 30 weeks after adalimumab administration. UWFA scores for vascular and capillary leakage were decreased at 30 weeks (p = 0.032, p = 0.004), while the UWFA scores for disc hyperfluorescence persisted (p = 0.083). Although vascular and capillary leakage at the posterior pole was significantly decreased at 6, 14, and 30 weeks, there was no significant change of the score for peripheral vascular and capillary leakage from baseline to 6 weeks, from 6 to 14 weeks, and from 14 to 30 weeks.
ë°°ìČŽížëłì ë§ì±ì ìŒëĄ ì
íì ìíë„Œ ë°ëł”íë ì ì ìŒìŠ ì§íìŒëĄ, ê”Źê° ë° ì±êž° 궀ì, íŒë¶ ì§í, íŹëë§ìŒì ëč륯íìŹ ë€ìí ë¶ìì ìŒìŠì ì ë°í ì ìë€. ì ìČŽ ëČ ìČŽížëłì ìœ 30-70%ìì ìê”Ź ìŠììŽ ëë°ëë©°, ìŁŒëĄ ë§ì±ì ìŒëĄ ìŹë°íë ììì± ì ìČŽíŹëë§ìŒ, ë§ë§íêŽìŒ ë±ì ííëĄ ëíëë€[1-6].
ëČ ìČŽíž íŹëë§ìŒìì ì ì ìœë„Ží°ìœì€í
ëĄìŽë ìčëŁê° ê°ì„ ë늏 ìŹì©ëêł ìë ìčëŁ ë°©ëČìŽë©°, mycophenolate mofetil (MMF), methotrexate, azathioprine (AZA), cyclosporine ë±êłŒ ê°ì ë©Žìì”ì ì ë„Œ ëłì©íšìŒëĄìš ì€í
ëĄìŽëì ë¶ìì©ì ì€ìŽêł , ìŒìŠ ì”ì íšêłŒì ìŠëë„Œ ì ëí ì ìë€. ì”ê·Œìë interferon-α, tumor necrosis factor-α (TNF-α) inhibitor ë±ì ìëŹŒíì ì ì ê° ê°ë°ëë©Žì ìĄ°ì ëì§ ìë ë§ì±ì ìŽêł ìŹê°í íŹëë§ìŒìì ìŒìŠ ì”ì ë° ì„êž°ì ìž ìë „ ê°ì ì íšêłŒê° ëłŽêł ëêł ìë€[5-9]. ìì ì°ê”Źë€ìì ë§ì± ëčê°ìŒì± íŹëë§ìŒì ìčëŁëĄìš infliximab, adalimumab (ADA) ë±êłŒ ê°ì TNF-α inhibitorì íšêłŒì ìì ì±ìŽ ì
ìŠë ë° ììŒë©°, ìŽ ì€ ADAë 돎ìì ëìĄ°ê”° ì°ê”Źë„Œ ë°íìŒëĄ ì±ìžì ëčê°ìŒì± ì€ê° íŹëë§ìŒ, ííŹëë§ìŒ, ì ìČŽíŹëë§ìŒì ìčëŁëĄìš ì ìŒíêČ ëŻžê” Food and Drug Administration ë° European Medicines Agencyì ìíŽ ìčìžë ìœì ìŽë€[10-13].
íêŽìì íêŽìĄ°ìì (fluorescein angiography, FA)ì íìĄë§ë§ì„ëČœ ëŽìž”ì íꎎì ìí í룚ì€ë ì ìĄ°ìì ì ëì¶ ì ëì ë°ëŒ ëČ ìČŽížëłêłŒ êŽë šë ë§ë§íêŽìŒ ë±ì ííŹëë§ìŒìì ìŒìŠì ì ëì ëČìë„Œ íê°íë ì ì©í êČìŹ ë°©ëČìŽë€[14,15]. êž°ìĄŽì êł ìì FAì êČœì° íê·čë¶ 30-50°ì ììë§ êŽì°°ìŽ ê°ë„íììŒë, í ëČì ìŽŹììŒëĄ 200° ëČìë„Œ ìŽŹìí ì ìë ìŽêŽê°íêŽìì íêŽìĄ°ìì (ultra-widefield fluorescein angiography, UWFA)ìŽ ëì
ë ìŽíëĄ ë§ë§íêŽìŒì ëč륯í ëčëšë§ë§ëłìŠ, ë§ë§ì 맄íì, 맄ëœë§ìą
ì ë±ì ë€ìí ë§ë§ ì§íìì UWFAì ì ì©ì±ìŽ ëłŽêł ëìêł , ëČ ìČŽížëłêłŒ êŽë šë ííŹëë§ìŒì ìíë„Œ ëłŽë€ ê°êŽì ìŒëĄ ìíë„Œ íê°íêł ìčëŁë„Œ êČ°ì íë ë°©ëČìŒëĄë ìŽì©ëêł ìë€[14-18].
ëłž ì°ê”Źììë UWFAë„Œ ìŽì©íìŹ ëČ ìČŽížëł ííŹëë§ìŒì ADAì ëí ìčëŁ ë°ìì íê°íêł ìŽë„Œ í”íŽ UWFAì ì ì©ì±ì íìžíêł ì íìë€. ëí ëČ ìČŽíž ííŹëë§ìŒì ìčëŁ ë°ìì UWFAì ììì ë°ëŒ ê”Źë¶íìŹ ë¶ìíêł ì íìë€.
ëłž ì°ê”Źë íŹì±í€ ì ìžì ì
ê°í ìíì°ê”Ź ì€ëŠŹìŹìììíì ìčìž ìë ì§íëììŒë©°, ëłž ì°ê”Źì êŽë šë ìŽíŽêŽêłì ì충ì ìë€(ìčìžëČíž: H-1901-007-999).
2017ë
9ìë¶í° 2021ë
1ìêčì§ ëšìŒêž°êŽì ëŽìíìŹ ëČ ìČŽížëłì ëë°ë ííŹë§ìŒì ëíŽ ìëŹëŠŹëŹŽë§ ìčëŁë„Œ ììíêł 30ìŁŒ ìŽì êČœêłŒ êŽì°°í 17ëȘ
ì 32ìì ëìëĄ íí„ì ìŒëĄ ìëŹŽêž°ëĄì ë¶ìíìë€. ì°ê”Ź ëìì ì ì êž°ì€ì (1) International Study Group for Behcetâs disease criteria ì ë°ë„ž ëČ ìČŽížëłì ì§ëšë°ì êČœì°, (2) ìœë„Ží°ìœì€í
ëĄìŽë ë° ì ì ë©Žìì”ì ì ì ì ì í ë°ìì ëíëŽì§ ìê±°ë ë¶ìì© ë±ìŒëĄ ìčëŁë„Œ ì€ëší íŹëë§ìŒì ëíŽ ìëŹëŠŹëŹŽë§ ìčëŁë„Œ ìíí êČœì°, (3) ìëŹëŠŹëŹŽë§ ìčëŁ í 30ìŁŒ ìŽì êČœêłŒ êŽì°°ì ìíí êČœì°ìŽë©°, íŽëč ìĄ°ê±Žì ëȘšë ë§ìĄ±íë íìë€ì íŹíšíìë€[19]. ëČ ìČŽíž íŹëë§ìŒ ìž ìŹí ëčëšë§ë§ëłìŠ, ë§ë§íêŽíì ë± ë§ë§íêŽì ìčšëČíë ì§íìŽë, ë§ë§ì ë§, í©ë°ìêł”êłŒ ê°ìŽ ìë „ ëłíì ìí„ì 믞ìčë ë€ë„ž ìì§íìŽ ëë°ë êČœì°, ì”ëê”ì ìë „ìŽ ìì ìì§ ìŽíìž êČœì°, ìëŹëŠŹëŹŽë§ ìčëŁ ìì í ëłëłìì ë°±ëŽì„ìì êłŒ ê°ì ì êž°ë„Œ ìíë°ì êČœì°, ë§€ì§ íŒíìŽ ìŹíìŹ ìíí êČìŹì ëí íê°ê° ìŽë €ìŽ êČœì° ì°ê”Ź ëììì ì ìžíìë€.
ADA (HumiraÂź; Abbott Laboratories, Madrid, Spain) ìčëŁë„Œ ììíêž°ì ìì ëȘšë íìë€ì ììží ëłë „ ìČì·šì íšê» íë¶ ë°©ìŹì ìŽŹì, interferon-gamma release assaysë„Œ íŹíší íìĄêČìŹë„Œ ìííìêł , Bí, Cí ê°ìŒ ë° ì ëł”êČ°í” ë±ì ê°ìŒ ìŹë¶ë„Œ íìžíìë€. 0ìŁŒì°šì 80 mgì íŒíëĄ ìŁŒìŹí ìŽí 1ìŁŒ ë€ 40 mgì íŒíìŁŒìŹíêł , 2ìŁŒ ê°êČ©ìŒëĄ 40 mg íŒíìŁŒìŹë„Œ ì§ìíììŒë©°, ìčëŁ ìì í 6ìŁŒ ìŽí 4ìŁŒë§ë€ ìčëŁ ë°ìì íê°íìë€. ì¶ì êŽì°° ì ëłëłìì ìŒìŠ ì ëì ë°ëŒ ëłì© ì€ìž ì€í
ëĄìŽë ë° ì ì ë©Žìì”ì ì ì ì©ëì ìĄ°ì íìë€.
ëȘšë íììì ADA ìčëŁ ìì ì êłŒ ì¶ì êŽì°° ì ì”ëê”ì ìë „, ìì, ìžê·čë±í믞êČœêČìŹë„Œ ìííììŒë©°, ìì êČìŹ, ëčê°ìëšìž”ìŽŹìêČìŹë„Œ ìííìŹ ìŒìŠì ì ëì ììì íìžíìë€. ì ë°©ì ìŒìŠêłŒ ì 늏ìČŽ ìŒìŠì êČœì° Standardization of Uveitis Nomenclature Working Group criteriaì ë°ëŒ íê°íììŒë©°, ëłì© ì€ìž ìœì ì ì©ëêłŒ ìčëŁì ëĄ ìží ë¶ìì© ë±ì íìžíìë€[20]. ëčê°ìëšìž”ìŽŹìêž°(Cirrusâą HD-OCT; Carl Zeiss Meditec, Dublin, CA, USA)ì ëŽì„ë ìíížìšìŽë„Œ ìŹì©íìŹ ì€ìŹê”Źì í©ë°ëê»(central subfield macular thickness)ë„Œ ìžĄì íìë€.
ADA ìčëŁ ìì ì êłŒ ìčëŁ ìì 6ìŁŒì§ž, ìŽí 8ìŁŒ ê°êČ©ìŒëĄ ìčëŁ ë°ì íê°ë„Œ ìíŽ Optos Optomap panoramic 200A imaging system (Optos plc, Dunfermline, Scotland)ì ìŽì©íìŹ UWFAë„Œ ìííìêł , Angiography Scoring for Uveitis Working Group (ASUWG)ìì ì ìí ë°©ëČì ìŽì©íìŹ ìêž°ëł UWFA ì ìë„Œ ìžĄì íìë€. ìì êČœì ë êłŒíêŽ, ë§ë§ ì 맄 íêŽëì¶, ëȘšìžíêŽ íêŽëì¶ì ëč륯í 9ê°ì íëȘ©ì ëíŽ íê°íììŒë©°, ë§ë§íêŽ íêŽëì¶ì êČœì° ì€ìŹë¶ì ìŁŒëłë¶ëĄ ê”Źë¶íìŹ ì ìë„Œ ìžĄì íìë€(Table 1) [21].
í”êł ë¶ìì Statistic package for social science version 27.0 íëĄê·žëš(SPSS Inc., Chicago, IL, USA)ì ìŽì©íìêł , ìčëŁ ìì ì êłŒ ì¶ì êŽì°° ìêž°ëł ì°ìì± ëłìì ëčê”ë paired t-test, ëłëłìììì ìê°ì ë°ë„ž ëłìì ëłíë repeated measures analysis of varienceë„Œ ìŽì©íìŹ ë¶ìíìë€. ì ììì€ 0.05 믞ë§ìž êČœì°ë„Œ í”êłíì ììê° ìë êČìŒëĄ íì íìë€.
ìŽ 17ëȘ
ì 32ìì ëììŒëĄ ì°ê”Źê° ì§íëìêł , ëì íìë€ì íê· ëìŽë 42.72 ± 11.93ìž, ëšìê° 6ëȘ
, ìŹìê° 11ëȘ
ìŽìë€. ADA ìčëŁë„Œ ììíêž° ì êčì§ì íê· ëČ ìČŽíž íŹëë§ìŒ ì ëł êž°ê°ì 10.38 ± 7.37ë
ìŽìêł , ëȘšë íììì ADA ìčëŁ ìì ì íê· 13.98 ± 5.60 mg/dayì íë ëëìëĄ ì ì ë„Œ ëł”ì© ì€ìŽìë€. ëí ìŽ 15ëȘ
ì 28ììì ì ì ë©Žìì”ì ì ìčëŁë„Œ ëłì© ì€ìŽììŒë©°, 17ììì MMF, 14ììì cyclosporine, 2ììì AZA, 2ììì tacrolimus ë„Œ ëł”ì© ì€ìŽìë€. ìŽ 17ìììë ADA ìčëŁ ìì ìŽì ì ì 늏ìČŽê°ëŽ, í
ë
Œëí ì€í
ëĄìŽëìŁŒìŹ ìčëŁë„Œ íŹíší íê· 2.22 ± 2.93íì ê”ì ì€í
ëĄìŽëìŁŒìŹ ìčëŁë„Œ ìíë°ìë€ (Table 2).
ì”ëê”ì ìë „ì êČœì° ADA ìčëŁ ìì í 6ìŁŒì 0.28 ± 0.42, 14ìŁŒì 0.29 ± 0.41, 30ìŁŒì 0.28 ± 0.40ìŒëĄ ADA ìčëŁ ìì ì ìž 0.39 ± 0.43êłŒ ëčê”íìì ë ëȘšë ì¶ì êŽì°° ìêž°ìì ì ìí ìë „ ížì ì 볎ììŒë©°, ì ë°©ìŒìŠ ì ëì ì 늏ìČŽí늌 ì ë ëí ADA ìčëŁ ìì ì ì ê°ê° 0.75 ± 0.61, 0.88 ± 0.61ìŽììŒë©° 6ìŁŒì 0.38 ± 0.38, 0.41 ± 0.50, 14ìŁŒì 0.25 ± 0.36, 0.25 ± 0.44, 30ìŁŒì 0.22 ± 0.38, 0.16 ± 0.37ëĄ ëȘšë ì¶ì êŽì°° ìêž°ìì ADA ìčëŁ ìì ì ëłŽë€ ì ìí ê°ìê° ììêł , ìž íëȘ© ëȘšë ìê°ì ë°ë„ž ì ìí ì í ê°ìë„Œ íìží ì ììë€(p=0.001, p<0.001, p<0.001) (Table 3).
UWFA ìŽí© ì ìë ADA ìčëŁ ìì ì 10.63 ± 5.95ì ìì ìčëŁ ìì í 6ìŁŒì 9.50 ± 5.20ì , 14ìŁŒì 8.63 ± 4.40ì , 30ìŁŒì 7.84 ± 3.88ì ìŒëĄ ëȘšë ì¶ì êŽì°° ìêž°ë§ë€ ì§ìì ìŒëĄ ì ìí ì ìì ê°ìë„Œ 볎ììŒë©°, ì”ëê”ì ìë „, ì ë°© ìŒìŠ ì ë, ì 늏ìČŽí늌 ì ëì ë§ì°Źê°ì§ëĄ ìê°ì ë°ë„ž ì ìí ì í ê°ì ìêČŹì êŽì°°í ì ììë€(p<0.001). ìŁŒëĄ ë§ë§ì 맄ììì íêŽëì¶ì ì믞íë ë§ë§íêŽì íêŽëì¶êłŒ ëȘšìžíêŽì íêŽëì¶ì êČœì° ADA ìčëŁ ìì ì êłŒ ëčê”íìì ë ëȘšë ì¶ì êŽì°° ìêž°ìì ì ìí íêŽëì¶ ì ëì ížì ì 볎ìëë° ë°íŽ ìì êČœ êłŒíêŽ, í©ë°ë¶ìą
ë±ì íëȘ©ììë ëȘšë ìêž°ìì ì ìí ëłíë„Œ êŽì°°í ì ììë€(Table 4). ë¶ê°ì ìŒëĄ ë§ë§ì ë§„êłŒ ëȘšìžíêŽì íêŽ ëì¶ ìêČŹì ì€ìŹë¶ìž íê·čë¶ì ê·ž ìŽìžì ìŁŒëłë¶ ìììŒëĄ ëëìŽ ë¶ìì ìííìêł , ADA ìčëŁ ìì ì êłŒ ëčê” íìì ë ì€ìŹë¶ íêŽëì¶ì êČœì° ëȘšë ìêž°ìì ì ìí íêŽëì¶ì ížì ì ëłŽìŒ ëż ìëëŒ, 6-14ìŁŒ, 14-30ìŁŒ ìŹìŽì ì ìí ížì ìêČŹì êŽì°°í ì ììë€. ë°ë©Ž ìŁŒëłë¶ íêŽëì¶ì êČœì° ADA ìčëŁ ìì ì êłŒ ëčê”íìì ë 14ìŁŒ, 30ìŁŒìë ì ìí íêŽëì¶ ížì ìêČŹì êŽì°°í ì ììì§ë§, ADA ìčëŁ ìì ì ìì ìčëŁ í 6ìŁŒ, 6-14ìŁŒ, 14-30ìŁŒ ê° êž°ê° ëìì ì ìí ëłíë êŽì°°ëì§ ììë€(Fig. 1).
ADA ìčëŁ ìì ìì ìì ì ì ì€í
ëĄìŽëì ëł”ì©ëì íê· 13.98 ± 5.60 mg/dayììŒë ADA ìčëŁ ìì íì ì ì§ì ìž ëł”ì©ëì ê°ëìŽ ìììŒë©°, ìčëŁ 30ìŁŒìë íê· 6.95 ± 3.22 mg/dayêčì§ ëł”ì©ëì ê°ëí ì ììë€(p<0.001) ê·žì ë°íŽ ë€ë„ž ì ì ë©Žìì”ì ì ì êČœì° ADA ìčëŁ ìì ì êłŒ ëčê”íìì ë ê° ìêž°ëł ì ìí ëłíë ììë€(Table 5). ADA ìčëŁ ì€ ìčëŁ ìì 6ìŁŒì§žìë ì ì ì€í
ëĄìŽëëĄ ìží ìČŽì€ ìŠê° ë° ìë©Žë¶ìą
1ëȘ
, ìì ìŠê° 1ëȘ
, ë¶ë©ŽìŠ 1ëȘ
ìŽ íìžëììŒë©°, 14ìŁŒì§žìë ìČŽì€ ìŠê° 1ëȘ
, 30ìŁŒìë ë¶ìì©ìŽ íìžëì§ ììë€. ëí ADA ìčëŁ ì€ ADA ìčëŁë„Œ ì€ëšíŽìŒ í ì ëì ìŹê°í ë¶ìì© ëë ìŒìŠì ìŹë° ìêČŹì êŽì°°ëì§ ììë€.
íŹëë§ìŒìŽ ëë°ë ëČ ìČŽížëłìì ìëŹëŠŹëŹŽë§ì ìčëŁ íšêłŒì ëí ê”ëŽ ëłŽêł ë ì íì ìŽë©°, ëłž ì°ê”Źììë ê”ëŽ íìë„Œ ëììŒëĄ íìŹ ìëŹëŠŹëŹŽë§ ìčëŁ í ìë „ì ížì êłŒ íšê» ìŒìŠ ì ëì ížì ë± ëČ ìČŽíž íŹëë§ìŒìì ADAì ìčëŁ íšêłŒë„Œ ëłŽêł íìë€. ìŽë ìì ì§íëìë ëČ ìČŽížëłì íŹíší ëìčì± ëčê°ìŒì± íŹëë§ìŒìì ADAì íšêłŒë„Œ ì°ê”Źíë ì°ê”Źë€êłŒ ê°ì êČ°êłŒë„Œ 볎ìë€[14,22-24]. ëë¶ìŽ ëłž ì°ê”Źììë ADA ìčëŁ ìŽí ì ì ì€í
ëĄìŽë ëł”ì©ëì ì ìí ê°ìë„Œ íìžíììŒë©°, ìŽë„Œ í”íŽ ADA ìčëŁë ì ì ì€í
ëĄìŽë ìŹì©ì ì€ìŒ ì ìêł , ê·žëĄ ìží ë¶ìì©ì ë§ë ìí ë í ì ììì íìžíìë€.
íêŽìì íêŽìĄ°ìì ì ë§ë§ ë° ë§ë§íêŽì ìíë„Œ ëłŽë€ ì ë°íêČ íê°í ì ììŽ ë§ë§íêŽìŒì ëč륯í ë€ìí ë§ë§íêŽ ì§íìì ë늏 ìŽì©ëêł ììŒë©°, íìì±, ꎎìŹì± ë§ë§íêŽìŒì ììŁŒ ëë°íë ëČ ìČŽíž íŹëë§ìŒììë ííŹëë§ìŒì íê°íë ë° ì ì©íêČ ìŹì©ëë êČìŹ ë°©ëČìŽë€[25,26]. êž°ìĄŽì ìŽì©ëìë êł ìì FAì êČœì° 30-50ë ëČìì íê·čë¶ ë§ë§íêŽ ìĄ°ììŽ ê°ë„íìŹ, êČìŹìì ëì ìë šëê° íìíë©° ìĄ°ìì íŹìŹ í ëìŒí ìê°ì ìŁŒëłë¶ì íêŽìŽìì íì
íë ë° ììŽì ì íì ìŽ ììë€. UWFAì êČœì° ìŁŒëłë¶ 200ë ëČìì ë§ë§êčì§ ìŽŹììŽ ê°ë„íìŹ êł ìì FA ëĄë íê°ê° íë€ìë ìŁŒëłë¶ ë§ë§ ë° ë§ë§íêŽ ìíë„Œ ëłŽë€ ìœêł ê°ížíêČ êČìŹí ì ìêČ íŽìŁŒìêł , ìŽëŹí UWFA ì ì„ì ì ìŽì©íìŹ ëČ ìČŽíž íŹëë§ìŒì ëč륯í íŹëë§ìŒìì ì§ëš ë° ìčëŁ ë°ì íê°ë¶ìì ìíí ì°ê”Źë€ìŽ ì§íëìë€[16,18,26-28]. Leder et al [29]ì 23ëȘ
ì íŹëë§ìŒ íìë„Œ ëììŒëĄ êł ìì FA, UWFAë„Œ ìííìŹ íŽëč êČìŹë„Œ í”íŽ ì§ëłì íì±ì íìží ì ìë ëčìšì ìžĄì íìêł , UWFAìì ì§ëł íì±ì íìží ëčìšìŽ 68%ìêł , ìŽë êł ìì FA ìì ì§ëłìŽ íìžë 45%ëłŽë€ ì ìíêČ ëìë€. ëí íŽëč êČìŹë„Œ í”íŽ ìčëŁ ë°©ëČì ëłêČœíìë ëčìšì ëčê”íìëë°, êł ìì FAì êČœì° 10%ìì ìčëŁ ë°©ëČì ëłêČœíìêł UWFA ì êČœì° 51%ìì ìčëŁ ë°©ëČì ëłêČœí êČ°êłŒë„Œ 볎ììŒë©°, ìŽë„Œ í”íŽ íŹëë§ìŒì ì§ëš ë° ìčëŁìì UWFAì ê°ìčë„Œ ì
ìŠíìë€. Uzlu et el [30]ì ëìčì± ëčê°ìŒì± íŹëë§ìŒì ìêł ìë 23ëȘ
ì 44ìì ëììŒëĄ ADA ìčëŁë„Œ ìíí ìŽí UWFA ë±ì í”íŽ ìčëŁ ë°ì íê°ë„Œ ìííììŒë©°, íêŽ ëì¶ì ëČìë„Œ êž°ì€ìŒëĄ ADA ìčëŁ ìì ì ì ëčíŽ ìčëŁ í 3ê°ì, 6ì짞 ì ìí íêŽëì¶ ëČìì ê°ìê° ìììì íìžíìë€. ëČ ìČŽíž íŹëë§ìŒ íìë„Œ ëììŒëĄ ë§ë§íêŽìŒì ì ëë„Œ íê°í ì°ê”Źììë UWFAë„Œ ìŽì©íìŹ ë§ë§íêŽìŒì íìžíêł , ASUWGìì ì ìí ì ì ìžĄì ë°©ëČì ìŽì©íìŹ ìŒìŠì ì ëë„Œ ë¶ìíììŒë©°, êł ìì FAë„Œ ìŽì©í ì ìì ëčê”íìì ë UWFAì íì© ê°ë„ì±ì ëłŽêł íêž°ë íìë€[31]. ëłž ì°ê”Źììë ASUWGìì ì ìí ë°©ëČì ë°íìŒëĄ ëČ ìČŽíž ííŹëë§ìŒ íìì UWFA ì ìë„Œ ìžĄì íììŒë©°, ADA ìčëŁ ìì ì ë¶í° ADA ìčëŁ 6ìŁŒ, 14ìŁŒ, 30ìŁŒêčì§ ìê°ìŽ ì§ëë©Žì ì§ìì ìŒëĄ UWFA ì ìì ê°ì, ìŠ ííŹëë§ìŒ íì±ì ê°ìë„Œ íìží ì ììë€. ìŽë ADA ìčëŁ ìŽí BCVA, ì ë°© ìŒìŠ, ì 늏ìČŽí늌 ì ëì ì§ìì ìž ížì êłŒ ê°ì íëŠì 볎ìŹìŁŒë êČ°êłŒëĄ ëČ ìČŽíž íŹëë§ìŒ íììì ADAì ìčëŁ ë°ì íê° ë°©ëČìŒëĄìš UWFAì íì© ê°ë„ì±ì 볎ìŹìŁŒìë€êł ë§í ì ìë€.
ëłž ì°ê”Źììë ADA ìčëŁ ìì ìŽí UWFA íê°ë„Œ í”íŽ ëȘšìžíêŽì íŹíší ë§ë§íêŽì íêŽ ëì¶, ìŒììŽ ì§ìì ìŒëĄ ê°ìíšì íìžíìì§ë§, ìì êČœì ë êłŒíêŽì êČœì° ê°ìíë êČœí„ì 볎ìŽë ì ìí ëłíë ììë€. ìì ì°ê”Źìì ëłŽêł ë êČìČëŒ ëȘšìžíêŽì íŹíší ë§ë§íêŽì íêŽëì¶ì ííŹëë§ìŒì íì±ëë„Œ 볎ìŹìŁŒë©°, ìčëŁ ë°ìì íê° íêł ìčëŁë„Œ êČ°ì íë ë° ìŹì©ëë ìêČŹ ì€ íëìŽë€[28,32]. Keino et el [33]ì ëČ ìČŽíž ííŹëë§ìŒìì infliximab ìčëŁê° ë§ë§íêŽ íêŽëì¶ ì ëì 믞ìčë ìí„ì ë¶ìíìêł ìčëŁ í íêŽëì¶ì ì ìí ê°ìê° ììì íìžíìë€. Kim et el [14] ì°ê”Źìì ëí ADA ìčëŁì ëíŽ ëȘšìžíêŽ ë° ë§ë§ì 맄ì íêŽëì¶ì ì ìí ê°ìë„Œ íìžíììŒë©°, ë°ë©Ž ìì êČœì ëì êłŒíêŽì ëčê”ì ì§ìëë êČ°êłŒë„Œ 볎ìë€. ìŽë ëłž ì°ê”Źì êČ°êłŒì ììíë êČ°êłŒìŽë©°, BCVA, ì ë°© ìŒìŠ, ì 늏ìČŽí늌 ë± íŹëë§ìŒì ìíì êŽë šë ìžìë€ì ADA ìčëŁ í ëłíë„Œ êł ë €íìì ë ìì êČœì ë êłŒíêŽì ëčíŽ ëȘšìžíêŽì íŹíší ë§ë§ì 맄ì íêŽëì¶ì ëí íê°ê° ëČ ìČŽíž ííŹëë§ìŒì íì±ëêłŒ êŽë šìŽ ìë€êł ìê°í ì ìë€.
ííž, UWFAì ëì
ìŒëĄ ìŁŒëłë¶ ë§ë§ì ëí êČìŹê° ê°ë„íŽì§ë©Žì ìŁŒëłë¶ ë§ë§íêŽìŒì ëí ì°ê”Źë€ ëí ì§íëìëë°, Campbell et el [32]ì íŹëë§ìŒìì ìŁŒëłë¶ ë§ë§íêŽì íêŽëì¶ë§ìŒëĄë ììì ìž í° ìëŻžê° ìì§ë§, í©ë°ë¶ìą
êłŒ ê°ì ë€ë„ž íêŽìĄ°ìì êČìŹ ìêČŹìŽë ìŒìŠì íì±ëë„Œ 볎ìŽë ë€ë„ž ìì ì 볎ë€êłŒì ì ìí êŽë šì±ì ëłŽìŒ ì ìë€êł ìŁŒì„íìë€. ë€ë„ž ì°ê”Źììë ìŁŒëłë¶ ë§ë§íêŽì íêŽëì¶ìŽ ì€ìŹë¶ íêŽëì¶êłŒì êŽë šì±ì ìì§ë§, ìë „ ìíìì ì ìí êŽë šì±ì ì ìŒë©°, êł ìì FA ìêČŹêłŒ ëčê”íìŹ ì¶ê°ì ìž ìŁŒëłë¶ ë§ë§íêŽìĄ°ì ìêČŹìŽ ìčëŁë„Œ êČ°ì íë ë°ìë ìí„ì 믞ìč ì ìë€ë ì°ê”Ź êČ°êłŒë ìë€[18,34,35]. ìŽë ëŻ ëłž ì°ê”Źììë ADA ìčëŁì ë°ë„ž ìŁŒëłë¶ ë§ë§íêŽì íêŽëì¶ì ëłí ììì íìžíêł , ìŽë„Œ ì€ìŹë¶ ë§ë§íêŽì íêŽëì¶ ììêłŒ ëčê”íŽëłŽêł ì íìë€. ADA ìčëŁ ìì ì êłŒ ëčê”íìŹ ì€ìŹë¶ ëȘšìžíêŽ ë° ë§ë§ì 맄ì íêŽëì¶ ì ëë ìčëŁ ìì í 6ìŁŒì§žë¶í° ì§ìì ìŒëĄ ì ìí ê°ì ìêČŹì 볎ìë€. ê·žëŹë ìŁŒëłë¶ ëȘšìžíêŽ ë° ë§ë§ì 맄ì íêŽ ëì¶ ì ëë ìčëŁ ìì ì êłŒ ëčê”íìì ë ìčëŁ ìì í 14ìŁŒì§žë¶í° ì ìí ê°ìë„Œ êŽì°°í ì ììêł , ìčëŁ ìì ì ìì 6ìŁŒ, 6ìŁŒìì 14ìŁŒ, 14ìŁŒìì 30ìŁŒ ê°ê°ì êž°ê° ëììë ëì¶ ì ëê° ê°ìíë êČœí„ì 볎ìì§ë§, ì ìí ëłíë êŽì°°ëì§ ììë€. ìŽë„Œ í”íŽ ADAì ìčëŁì íšê» íŹëë§ìŒì ížì ìŽ ìŽë€ì§ì ë°ëŒ ì€ìŹë¶ì ë§ë§íêŽ íêŽëì¶ì ì§ìì ìž ê°ìê° íìžëììŒë, ìŁŒëłë¶ììë ìëì ìŒëĄ íêŽëì¶ì ëłí ì ëê° ì ììì ì ì ììë€.
ëłž ì°ê”Źë ì°ê”Ź ëìì ìê° ì êł , íí„ì ìëŹŽêž°ëĄ ë¶ìì êž°ë°ìŒëĄ ì§íí ì°ê”ŹìŽëŻëĄ ì¶ì êŽì°° ìì ì ë°© ìŒìŠ ë° ì 늏ìČŽí늌ì ì ëë êČìŹìì ë°ëŒ ì°šìŽê° ìì ì ìêł , ë¶ìì©ì ì 돎ì ëí ì 볎ëëœìŽ ìì ì ìë€. ëí êČœêłŒ êŽì°° êž°ê°ìŽ 30ìŁŒëĄ ì§§ì ADAì ìčëŁíšêłŒ ë° UWFA ììì ë¶ìì ëí íŽìì ì íì ìŽ ìêž° ë돞ì í„í ë€ìì ëČ ìČŽíž íŹëë§ìŒ íìë„Œ ëììŒëĄ ADA ìčëŁ í ì„êž°ê°ì ì¶ì êŽì°°ì ìííë íì ì°ê”Źê° íìí êČìŒëĄ 볎ìžë€. ì¶ê°ì ìŒëĄ ííŹëë§ìŒì ìíë„Œ íê°íšì ììŽ UWFA íê° íëȘ© ê°ì êŽë šì±ì ëí ì°ê”Źê° íìí ììë€.
êČ°ëĄ ì ìŒëĄ UWFAë ëČ ìČŽíž ííŹëë§ìŒì ëí ADA ìčëŁ ë°ìì íê°íë ë° ì ì©íë©°, UWFAë„Œ í”íŽ ìčëŁ ë°ìì íê°íë ë° ììŽ ìì êČœì ë êłŒíêŽìŽë í©ë°ë¶ìą
볎ë€ë ë§ë§íêŽì íêŽëì¶ì ì ëë„Œ íì
íë êČìŽ ì€ìíë€. ëí ëȘšìžíêŽì íŹíší ë§ë§íêŽ íêŽëì¶ì ììčê° ì€ìŹë¶ìžì§ ìŁŒëłë¶ìžì§ì ë°ëŒ ëì¶ ììì ì°šìŽê° ìì ì ìë€.
Figure 1.
Ultra-widefield fluorescein angiography-based score change of vascular leakage at the posterior pole and peripheral area in patients with Behcetâs uveitis treated with adalimumab. Significant decrease of vascular leakage score at the posterior pole between baseline and 6 weeks, between 6 and 14 weeks, and between 14 and 30 weeks, whereas no significant change of the vascular leakage score at the peripheral area. The p-value was derived from paired t-test. *p < 0.05.
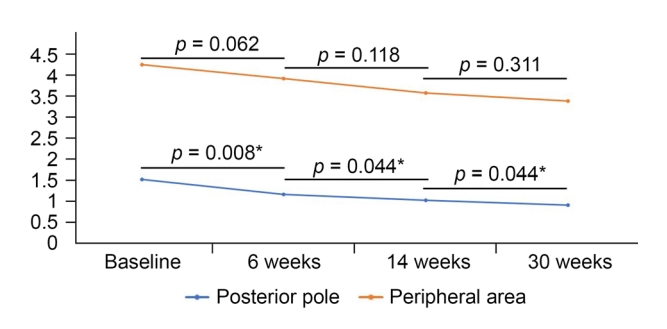
Table 1.
Fluorescein angiographic scoring system
Table 2.
Demographics and baseline ocular characteristics
Table 3.
Ocular characteristics change from baseline to 30 weeks after start of ADA
| Parameter | Baseline | 6 weeks | 14 weeks | 30 weeks | p-value⥠|
|---|---|---|---|---|---|
| BCVA (logMAR) | 0.39 ± 0.43 | 0.28 ± 0.42 | 0.29 ± 0.41 | 0.28 ± 0.40 | 0.001 |
| âp-value | 0.002â | <0.001â | 0.001â | ||
| IOP (mmHg) | 16.25 ± 3.57 | 15.50 ± 2.19 | 15.25 ± 2.46 | 14.72 ± 2.41 | 0.155 |
| âp-value | 0.147â | 0.146â | 0.022â | ||
| CSMT (Όm) | 267.31 ± 63.06 | 267.31 ± 59.75 | 261.94 ± 57.50 | 267.03 ± 66.52 | 0.892 |
| âp-value | 1.000â | 0.423â | 0.950â | ||
| Anterior chamber cell grade* | 0.75 ± 0.61 | 0.38 ± 0.38 | 0.25 ± 0.36 | 0.22 ± 0.38 | <0.001 |
| âp-value | <0.001â | <0.001â | <0.001â | ||
| Vitreous haze grade* | 0.88 ± 0.61 | 0.41 ± 0.50 | 0.25 ± 0.44 | 0.16 ± 0.37 | <0.001 |
| âp-value | 0.001â | <0.001â | <0.001â |
Values are presented as mean ± standard deviation.
ADA = adalimumab; BCVA = best corrected visual acuity; logMAR = logarithm of the minimum angle of resolution; IOP = intraocular pressure; CSMT = central subfield macular thickness.
Table 4.
UWFA score change from baseline to 30 weeks after start of ADA
| Parameter | Baseline | 6 weeks | 14 weeks | 30 weeks | p-valueâ |
|---|---|---|---|---|---|
| UWFA score | 10.63 ± 5.95 | 9.50 ± 5.20 | 8.63 ± 4.40 | 7.84 ± 3.88 | <0.001 |
| âp-value | 0.004* | 0.001* | <0.001* | ||
| Optic disc hyperfluorescence | 1.91 ± 0.78 | 1.81 ± 0.74 | 1.78 ± 0.71 | 1.72 ± 0.68 | 0.108 |
| âp-value | 0.083* | 0.211* | 0.083* | ||
| Macular edema | 1.34 ± 1.33 | 1.25 ± 1.30 | 1.31 ± 1.31 | 1.03 ± 0.93 | 0.011 |
| âp-value | 0.184* | 0.745* | 0.010* | ||
| Retinal vascular staining/leakage | 1.16 ± 1.69 | 0.91 ± 1.35 | 0.75 ± 1.16 | 0.56 ± 1.05 | 0.003 |
| âp-value | 0.030* | 0.010* | 0.002* | ||
| Capillary leakage | 4.66 ± 2.38 | 4.19 ± 2.56 | 3.88 ± 1.88 | 3.75 ± 1.88 | 0.007 |
| âp-value | 0.033* | 0.027* | 0.004* | ||
| Capillary nonperfusion | 0.13 ± 0.42 | 0.13 ± 0.42 | 0.13 ± 0.42 | 0.13 ± 0.42 | 1.000 |
| âp-value | 1.000* | 1.000* | 1.000* | ||
| NVD | 0.06 ± 0.25 | 0.06 ± 0.25 | 0.06 ± 0.25 | 0.06 ± 0.25 | 1.000 |
| âp-value | 1.000* | 1.000* | 1.000* | ||
| NVE | 0.03 ± 0.18 | 0.03 ± 0.18 | 0.03 ± 0.18 | 0.03 ± 0.18 | 1.000 |
| âp-value | 1.000* | 1.000* | 1.000* | ||
| Pinpoint leakage | 0.19 ± 0.47 | 0.16 ± 0.37 | 0.09 ± 0.30 | 0.09 ± 0.30 | 0.088 |
| âp-value | 0.325* | 0.083* | 0.083* | ||
| Retinal staining/subretinal pooling | 1.19 ± 1.72 | 1.03 ± 1.66 | 0.68 ± 1.35 | 0.55 ± 1.21 | 0.005 |
| âp-value | 0.169* | 0.027* | 0.009* | ||
| Vascular leak at posterior pole | 1.53 ± 1.24 | 1.16 ± 1.11 | 1.03 ± 1.09 | 0.91 ± 0.93 | <0.001 |
| âp-value | 0.008* | 0.001* | <0.001* | ||
| Vascular leak at peripheral area | 4.28 ± 2.41 | 3.94 ± 2.50 | 3.59 ± 1.97 | 3.40 ± 2.05 | 0.007 |
| âp-value | 0.062* | 0.027* | 0.006* |
Table 5.
Treatment change from baseline to 30 weeks after start of ADA
| Baseline | 6 weeks | 14 weeks | 30 weeks | p-valueâ | |
|---|---|---|---|---|---|
| Steroid (mg/day) | 13.98 ± 5.60 | 10.16 ± 4.26 | 8.36 ± 3.79 | 6.95 ± 3.22 | <0.001â |
| âp-value | <0.001* | <0.001* | <0.001* | ||
| MMF (mg/day) | 234.38 ± 237.06 | 203.13 ± 232.77 | 203.13 ± 232.77 | 195.31 ± 208.05 | 0.347 |
| âp-value | 0.161* | 0.161* | 0.282* | ||
| Cyclosporine (mg/day) | 41.94 ± 59.30 | 41.94 ± 46.72 | 41.13 ± 46.79 | 33.87 ± 45.44 | 0.161 |
| âp-value | 0.904* | 0.282* | 0.206* | ||
| AZA (mg/day) | 6.25 ± 24.59 | 0.00 | 0.00 | 0.00 | 1.000 |
| âp-value | 0.161* | 0.161* | 0.161* | ||
| Tacrolimus (mg/day) | 6.31 ± 24.58 | 6.31 ± 24.58 | 6.31 ± 24.58 | 6.31 ± 24.58 | 0.161 |
| âp-value | 1.000* | 1.000* | 1.000* |
REFERENCES
1) Saleh Z, Arayssi T. Update on the therapy of Behçet disease. Ther Adv Chronic Dis 2014;5:112-34.



2) Ideguchi H, Suda A, Takeno M, et el. Behçet disease: evolution of clinical manifestations. Medicine (Baltimore) 2011;90:125-32.


3) Davatchi F, Chams-Davatchi C, Shams H, et al. Behcetâs disease: epidemiology, clinical manifestations, and diagnosis. Expert Rev Clin Immunol 2017;13:57-65.


4) Deuter CM, Kötter I, Wallace GR, et al. Behçet's disease: ocular effects and treatment. Prog Retin Eye Res 2008;27:111-36.


5) Celiker H, Kazokoglu H, Direskeneli H. Conventional immunosuppressive therapy in severe Behcetâs uveitis: the switch rate to the biological agents. BMC Ophthalmol 2018;18:1-7.



6) Hu Y, Huang Z, Yang S, et el. Effectiveness and safety of anti-tumor necrosis factor-alpha agents treatment in Behcetsâ disease-associated uveitis: a systematic review and meta-analysis. Front Pharmacol 2020;11:941.



7) Moon JW, Song SJ, Koo BK, et el. Short-term effects and side effects of tacrolimus for Behcet's uveitis. J Korean Ophthalmol Soc 2007;48:1654-62.

8) Kim JH, Lee DW, Cho NC. The efficacy of infliximab in refractory uveitis. J Korean Ophthalmol Soc 2016;57:50-5.

9) Lee SH, Yoo YS, Oh HS. The effect of adalimumab on refractory uveitis. J Korean Ophthalmol Soc 2020;61:746-54.

10) Sfikakis PP, Kaklamanis PH, Elezoglou A, et al. Infliximab for recurrent, sight-threatening ocular inflammation in AdamantiadesBehçet disease. Ann Intern Med 2004;140:404-6.

11) Biester S, Deuter C, Michels H, et al. Adalimumab in the therapy of uveitis in childhood. Br J Ophthalmol 2007;91:319-24.



12) Jaffe GJ, Dick AD, Brézin AP, et al. Adalimumab in patients with active noninfectious uveitis. N Engl J Med 2016;375:932-43.


13) Nguyen QD, Merrill PT, Jaffe GJ, et al. Adalimumab for prevention of uveitic flare in patients with inactive non-infectious uveitis controlled by corticosteroids (VISUAL II): a multicentre, double-masked, randomised, placebo-controlled phase 3 trial. Lancet 2016;388:1183-92.


14) Kim BH, Park UC, Park SW, Yu HG. Ultra-widefield fluorescein angiography to monitor therapeutic response to adalimumab in Behcetâs uveitis. Ocul Immunol Inflamm 2021 Apr 1 doi: 10.1080/09273948.2021.1872652. [Epub ahead of print].

15) Kim M, Kwon HJ, Choi EY, et el. Correlation between fluorescein angiographic findings and visual acuity in Behçet retinal vasculitis. Yonsei Med J 2015;56:1087-96.



16) Nicholson BP, Nigam D, Miller D, et al. Comparison of wide-field fluorescein angiography and 9-field montage angiography in uveitis. Am J Ophthalmol 2014;157:673-7.



17) Park DG, Ryu G, Kim D, Sagong M. Correlations between macular microvascular alterations and peripheral ischemia in patients with branch retinal vein occlusion. J Korean Ophthalmol Soc 2020;61:491-9.

18) Pecen PE, Petro KF, Baynes K, et el. Peripheral findings and retinal vascular leakage on ultra-widefield fluorescein angiography in patients with uveitis. Ophthalmol Retina 2017;1:428-34.


19) Criteria for diagnosis of Behçet's disease. International study group for Behçet's disease. Lancet 1990;335:1078-80.

20) Jabs DA, Nussenblatt RB, Rosenbaum JT; Standardization of Uveitis Nomenclature (SUN) Working Group. Standardization of uveitis nomenclature for reporting clinical data. Results of the first international workshop. Am J Ophthalmol 2005;3:509-16.
21) Tugal-Tutkun I, Herbort CP, Khairallah M; Angiography Scoring for Uveitis Working Group (ASUWOG). Scoring of dual fluorescein and ICG inflammatory angiographic signs for the grading of posterior segment inflammation (dual fluorescein and ICG angiographic scoring system for uveitis). Int Ophthalmol 2010;30:539-52.


22) Takase K, Ohno S, Ideguchi H, et el. Successful switching to adalimumab in an infliximab-allergic patient with severe Behçet disease-related uveitis. Rheumatol Int 2011;31:243-5.


23) Bawazeer A, Raffa LH, Nizamuddin SH. Clinical experience with adalimumab in the treatment of ocular Behçet disease. Ocul Immunol Inflamm 2010;18:226-32.


24) Hiyama T, Harada Y, Kiuchi Y. Efficacy and safety of adalimumab therapy for the treatment of non-infectious uveitis: efficacy comparison among uveitis aetiologies. Ocul Immunol Inflamm 2022;30:951-8.


25) Yu HG, Kim MJ, Oh FS. Fluorescein angiography and visual acuity in active uveitis with Behçet disease. Ocul Immunol Inflamm 2009;17:41-6.


26) El-Asrar AMA, Herbort CP, Tabbara KF. Differential diagnosis of retinal vasculitis. Middle East Afr J Ophthalmol 2009;16:202-18.


27) Jones NP, Sala-Puigdollers A, Stanga PE. Ultra-widefield fundus fluorescein angiography in the diagnosis and management of retinal vasculitis. Eye (Lond) 2017;31:1546-9.



28) Kaines A, Tsui I, Sarraf D, Schwartz S. The use of ultra wide field fluorescein angiography in evaluation and management of uveitis. Semin Ophthalmol 2009;24:19-24.


29) Leder HA, Campbell JP, Sepah YJ, et al. Ultra-wide-field retinal imaging in the management of non-infectious retinal vasculitis. J Ophthalmic Inflamm Infect 2013;3:30.



30) Uzlu D, Köse B, Akyol N, et el. The evaluation of the efficacy of adalimumab in refractory non-infectious uveitis with ultra-widefield fundus fluorescein angiography. Int Ophthalmol 2022;42:2107-16.


31) Moon SW, Kim BH, Park UC, Yu HG. Inter-observer variability in scoring ultra-wide-field fluorescein angiography in patients with Behçet retinal vasculitis. Ocul Immunol Inflamm 2017;25:20-8.


32) Campbell JP, Beardsley RM, Palejwala NV, et al. Peripheral vascular leakage in uveitis: clinical and angiographic findings. Ophthalmology 2015;122:1269-70.


33) Keino H, Okada AA, Watanabe T, Taki W. Decreased ocular inflammatory attacks and background retinal and disc vascular leakage in patients with Behcet's disease on infliximab therapy. Br J Ophthalmol 2011;95:1245-50.





 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print