|
 |
| Ann Optom Contact Lens > Volume 21(1); 2022 > Article |
|
Abstract
ļ¬®ņĀü
ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņéĮņ×ģņłĀ Ēøä ļ░£ņāØĒĢ£ Ļ┤æļ▓öņ£äĒĢ£ ņä¼ņ£Āņä▒ Ēö╝ļ¦ēņØś ņ”ØņŗØ(fibrous ingrowth)ņØä ļ│┤Ļ│ĀĒĢśĻ│Ā, ļ¦łņØ┤ĒåĀļ¦łņØ┤ņŗĀņØä ņØ┤ņÜ®ĒĢ£ ņŚ¼Ļ│╝ĒżĻĄÉņĀĢņłĀņØä ņŗ£Ē¢ēĒĢ£ ņ”ØļĪĆņŚÉ ļīĆĒĢ┤ņä£ ļ│┤Ļ│ĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
ņ”ØļĪĆņÜöņĢĮ
6Ļ░£ņøö ņĀä ņÜ░ņĢłņØś ņŗĀņāØĒśłĻ┤Ćļģ╣ļé┤ņןņ£╝ļĪ£ ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņéĮņ×ģņłĀņØä ļ░øņØĆ 51ņäĖ ļé©ņ×É ĒÖśņ×ÉĻ░Ć ņłśņ░©ļĪĆņØś ļ¦łņé¼ņ¦Ć ļ░Å ņŚ¼Ļ│╝Ēżļ│ĄņøÉņłĀ(bleb needling)ņŚÉļÅä ņĢłņĢĢņØ┤ ļåÆņĢä ņŚ¼Ļ│╝Ēżņ×¼ĒśĢņä▒ņłĀ(bleb revision)ņØä ņŗ£Ē¢ēļ░øņĢśļŗż. ņłśņłĀ ņżæ ļ░®ņłśņ£ĀņČ£ņןņ╣ś ņĀäņ▓┤ņŚÉ Ļ▒Ėņ│É ņä¼ņ£Āņä▒ Ēö╝ļ¦ē ņ”ØņŗØņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. ņŚ¼Ļ│╝ĒżņŚÉņä£ ņä¼ņ£Āņä▒ Ēö╝ļ¦ēņØä ņĀ£Ļ▒░ĒĢśņśĆĻ│Ā ņןņ╣śņØś ĒīÉĻ│╝ ĒīÉļ¦ē ņé¼ņØ┤ ĒŗłņāłņŚÉ ņ׳ļŖö ņä¼ņ£Āņä▒ Ēö╝ļ¦ēļÅä ņĀ£Ļ▒░ĒĢśņśĆļŗż. ĻĘĖ ņØ┤Ēøä ļ¦łņØ┤ĒåĀļ¦łņØ┤ņŗĀ(0.3 mg/mL)ņØä ņĀüņŗĀ ņŖżĒÄĆņ¦Ćļź╝ 2ļČäĻ░ä ņĀÉņĀüĒĢ£ ļÆż Ļ▓░ļ¦ēņØä ļ┤ēĒĢ®ĒĢśņśĆļŗż. ņłśņłĀ 3ņŻ╝ Ēøä ņןņ╣śņØś ņ×¼ļģĖņČ£ņØ┤ ļ░£Ļ▓¼ļÉśņ¢┤ ņĢäļ®öļō£ ļ░®ņłś ņ£ĀņČ£ņןņ╣śņĀ£Ļ▒░ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņČöĒøä ņĢłņĢĢņØ┤ ņĪ░ņĀłļÉśņ¦Ć ņĢŖņĢä ņÜ░ņĢł ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż.
Abstract
Purpose
To report a case of fibrous tissue ingrowth after Ahmed valve implantation and bleb revision using mitomycin-C.
Case summary
A 50-year-old man, who had received an Ahmed implantation 6 months prior, underwent bleb revision due to persistent high intraocular pressure, despite massage and multiple needling attempts. Bleb encapsulation over the entire valve plate was observed, and the bleb was gently dissected. Fibrous ingrowth over the entire valve system was confirmed. The broad stalk-like fibrous tissue was firmly adhered to the valve system. It was removed by pulling the connected bleb, taking care not to cut the stalk. Then, the long stalk-like fibrous ingrowth along the cleft between valve leaflets and main plate was removed, in the same manner. A sponge soaked with mitomycin-C (0.3 mg/mL) was instilled for 2 minutes, and the conjunctiva was sutured. Two weeks after the surgery, conjunctival suture was performed due to Ahmed valve exposure. Three weeks later, the Ahmed valve was removed due to re-exposure. Trabeculectomy surgery was performed due to uncontrolled intraocular pressure.
ņŗĀņāØĒśłĻ┤Ćļģ╣ļé┤ņן, ĒżļÅäļ¦ēņŚ╝ņŚÉ ņØśĒĢ£ ņØ┤ņ░©ļģ╣ļé┤ņן ļō▒ņØś ļé£ņ╣śņä▒ ļģ╣ļé┤ņןņØś ņłśņłĀņĀü ņ╣śļŻīļĪ£ ĻĖ░ņĪ┤ņØś ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ ņÖĖņŚÉ ļŗżņ¢æĒĢ£ ļģ╣ļé┤ņן ņ£ĀņČ£ņןņ╣śĻ░Ć ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż. ļģ╣ļé┤ņן ļ░®ņłśņ£ĀņČ£ņןņ╣śņŚÉļŖö ļ░®ņłśņØś ĒØÉļ”äņØä ņĀ£ĒĢ£ĒĢśņ¦Ć ņĢŖļŖö Moltenoņןņ╣ś, Baerveldt ņןņ╣ś, Schocket tube shuntņÖĆ ņłĀ Ēøä ņĀĆņĢłņĢĢņØä ļ¦ēĻĖ░ ņ£äĒĢ┤ ļ░®ņłśņØś ņ£ĀņČ£ņØä ņĀ£ĒĢ£ĒĢśļŖö Krupin Denverņןņ╣ś, Josephņןņ╣ś, ņĢäļ®öļō£ņןņ╣ś ļō▒ņØ┤ ņ׳ļŗż[1-5]. ņØ┤ ņżæ ņĢäļ®öļō£ņןņ╣śļŖö ĒĢ£ņ¬Į ļ░®Ē¢źņ£╝ļĪ£ ļ░®ņłśņØś ĒØÉļ”äņØä ņĪ░ņĀłĒĢśļŖö ļ░ĖļĖīļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ¢┤ņä£ ņłĀ ņżæ ņ┤łĻĖ░ ņĀĆņĢłņĢĢņŚÉ ņØśĒĢ£ ņŚ¼ļ¤¼ ĒĢ®ļ│æņ”Ø ļ░£ņāØņØś ņ£äĒŚśņØä ņżäņØ╝ ņłś ņ׳ņ¢┤ ļé£ņ╣śņä▒ ļģ╣ļé┤ņן ņ╣śļŻīņŚÉ ĒØöĒ׳ ņé¼ņÜ®ļÉśļŖö ļ░®ņłśņ£ĀņČ£ņןņ╣śņØ┤ļŗż[6]. ĻĖ░ņĪ┤ ĻĄŁļé┤ņÖĖ ļ¦ÄņØĆ ņŚ░ĻĄ¼ņŚÉņä£ ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņéĮņ×ģņłĀņØś ņä▒Ļ│ĄļźĀņØä 1ļģäņŚÉ 71.1%ņŚÉņä£ 90.6%ļĪ£ ļŗżņ¢æĒĢśĻ▓ī ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ņ£╝ļ®░, ņłĀ Ēøä ĒĢ®ļ│æņ”Øņ£╝ļĪ£ ņĀĆņĢłņĢĢ, ļ¦źļØĮļ¦ēļ░Ģļ”¼, ņĀäļ░®ņČ£Ēśł, ņ£Āļ”¼ņ▓┤ņČ£Ēśł, ļ¦źļØĮļ¦ēņāüĻ░ĢņČ£Ēśł, ļ░ĖļĖīļ¦ēĒל, ļ░ĖļĖīņ£äņ╣śņØ┤ņāü ļō▒ņØä ļŗżņ¢æĒĢśĻ▓ī ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ļŗż[7-9].
ļģ╣ļé┤ņןņłśņłĀņŚÉņä£ļŖö ņłśņłĀ Ļ│╝ņĀĢ ņżæ mitomycin-C (MMC) Ēś╣ņØĆ ņłśņłĀ Ēøä 5-fluorouracil (5-FU) ļō▒ņØś ĒĢŁļīĆņé¼ņĀ£ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņłśņłĀ ņä▒Ļ│ĄļźĀņØä ļåÆņØ┤ĻĖ░ļÅä ĒĢ£ļŗż. ĒĢŁļīĆņé¼ņĀ£Ļ░Ć ņłĀ Ēøä ņāüņ▓ś ņ╣śņ£Ā Ļ│╝ņĀĢņ£╝ļĪ£ ņØĖĒĢ£ Ļ│╝ļŗżĒĢ£ ņä¼ņ£ĀĒÖö ļ░Å Ļ▓░ņ▓┤ ņĪ░ņ¦üņØś Ēö╝ļ¦ē ĒśĢņä▒ņØä ņ¢ĄņĀ£ĒĢśņŚ¼ ņĪ░ĻĖ░ ļ░®ņłśņ£ĀņČ£ņØä ņ┤ēņ¦äņŗ£Ēé©ļŗż[10].
ņĀĆņ×ÉļōżņØĆ ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņéĮņ×ģņłĀ Ēøä Ļ┤æļ▓öņ£äĒĢ£ ņä¼ņ£Āņä▒ Ēö╝ļ¦ēņØś ņ”ØņŗØņ£╝ļĪ£ ļ░®ņłśņ£ĀņČ£ ĒØÉļ”äņØ┤ ņĀĆĒĢ┤ļÉśņ¢┤ ņłĀ Ēøä ņĢłņĢĢņØ┤ ņāüņŖ╣ĒĢśļŖö ņ”ØļĪĆļź╝ Ļ▓ĮĒŚśĒĢśņśĆļŗż. ņŚ¼Ļ│╝Ēżņ×¼ĒśĢņä▒ņłĀ(bleb revision)ļĪ£ ņØ┤ļź╝ ņĀ£Ļ▒░ĒĢśĻ│Ā ņłśņłĀ Ļ│╝ņĀĢ ņżæ ĒĢŁļīĆņé¼ņĀ£ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņłśņłĀ ņä▒Ļ│ĄļźĀņØä ļåÆņØ┤Ļ│Āņ×É ĒĢśļŖö ņŗ£ļÅäļź╝ ĒĢśņśĆļŗż. ņłĀ Ēøä ņĢłņĢĢņØĆ ņĀĢņāüĒÖöļÉśņŚłņ£╝ļéś ļ░®ņłśņ£ĀņČ£ņןņ╣śņØś ļģĖņČ£ļĪ£ ņØĖĒĢ┤ ļ░®ņłśņ£ĀņČ£ņןņ╣śņĀ£Ļ▒░ņłĀņØä ņŗ£Ē¢ēĒĢśĻ▓ī ļÉ£ ņ”ØļĪĆ 1ņśłļź╝ Ļ▓ĮĒŚśĒĢśņŚ¼ ņØ┤ņŚÉ ļīĆĒĢ┤ ļ│┤Ļ│ĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
51ņäĖ ļé©ņ×É ĒÖśņ×ÉĻ░Ć Ļ│ĀņĢłņĢĢņ£╝ļĪ£ ļģ╣ļé┤ņן Ēü┤ļ”¼ļŗēņØä ļ░®ļ¼ĖĒĢśņśĆļŗż. ļŗ╣ļć©ļź╝ ņĢōĻ│Ā ņ׳ļŖö ĒÖśņ×ÉļĪ£ ņÜ░ņĢł ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”Ø ļ░Å ļ¦Øļ¦ēļČĆņóģņ£╝ļĪ£ ļ│ĖņøÉ ļ¦Øļ¦ē Ēü┤ļ”¼ļŗēņŚÉņä£ ņŚ¼ļ¤¼ ņ░©ļĪĆ ņ£Āļ”¼ņ▓┤Ļ░Ģļé┤ ņĢäļ░öņŖżĒŗ┤ ļ░Å ņśżņź¼ļŹ▒ņŖż ļō▒ ņĢĮļ¼╝ ņŻ╝ņ×ģņłĀņØä ņŗ£Ē¢ēļ░øņĢśļŗż. 2019ļģä 6ņøö ņÜ░ņĢł ņ┤łņØīĒīīņłśņĀĢņ▓┤ņ£ĀĒÖöņłĀ ļ░Å ņØĖĻ│ĄņłśņĀĢņ▓┤ņéĮņ×ģņłĀņØä ņŗ£Ē¢ēļ░øņĢśĻ│Ā ņÜ░ņĢł ņŗĀņāØĒśłĻ┤Ćļģ╣ļé┤ņןņ£╝ļĪ£ ļģ╣ļé┤ņן Ēü┤ļ”¼ļŗēņ£╝ļĪ£ ņØśļó░ļÉśņŚłļŗż. ĒÖśņ×ÉļŖö ņÜ░ņĢł ņŗĀņāØĒśłĻ┤Ćļģ╣ļé┤ņןņ£╝ļĪ£ 2020ļģä 6ņøö 2ņØ╝ ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņéĮņ×ģņłĀņØä ņŗ£Ē¢ēļ░øņĢśļŗż. ņłĀ ņĀä ņŗ£ļĀźņØĆ ņĢłņĀäņłśļÅÖ, ņĢłņĢĢņØĆ Ļ│©ļō£ļ¦īņĢĢĒÅēņĢłņĢĢĻ│äņāü 44 mmHgņśĆļŗż. ņłśņłĀ 1ņŻ╝ņØ╝ Ēøä ņĢłņĢĢņØĆ Ļ│©ļō£ļ¦īņĢĢĒÅēņĢłņĢĢĻ│äņāü 14 mmHgņśĆļŗż. ņØ┤Ēøä ņĢłņĢĢņØ┤ ļŗżņŗ£ ņāüņŖ╣ĒĢśņŚ¼ ņĢłĻĄ¼ ļ¦łņé¼ņ¦Ć ļ░Å ņĢĮļ¼╝ ņ╣śļŻī, ņĀäļ░®ņ▓£ņ×É, ņłśņ░©ļĪĆņØś ņŚ¼Ļ│╝Ēżļ│ĄņøÉņłĀ(bleb needling)ņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņĢłņĢĢņØ┤ ļåÆņĢä 2020ļģä 12ņøö 22ņØ╝ ņŚ¼Ļ│╝Ēżņ×¼ĒśĢņä▒ņłĀ(bleb revision)ņØä ņŗ£Ē¢ēļ░øņĢśļŗż.
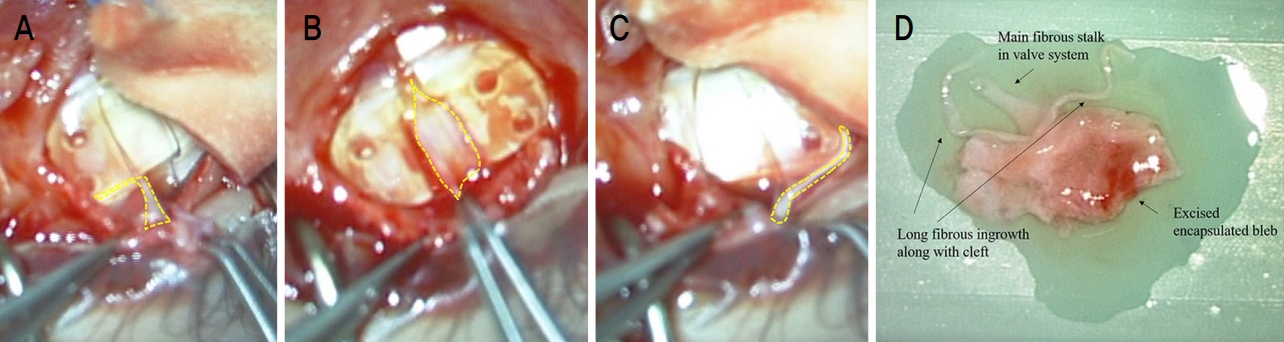
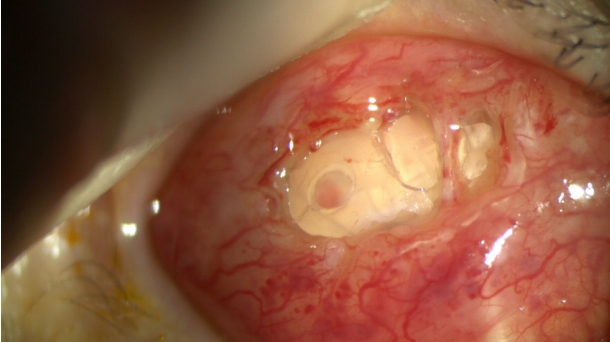
ņłśņłĀ ņżæ ņĀäņ▓┤ ļ░®ņłśņ£ĀņČ£ņןņ╣ś ĒīÉļ¦ē ņ£äņŚÉ ņŚ¼Ļ│╝Ēż Ēö╝ļ¦ē ĒśĢņä▒(bleb encapsulation)ņØ┤ Ļ┤Ćņ░░ļÉśņŚłĻ│Ā, ņŚ¼Ļ│╝Ēżļź╝ ņĪ░ņŗ¼ņŖżļĀł ļ░Ģļ”¼ĒĢśņśĆļŗż. ļ░®ņłśņ£ĀņČ£ņןņ╣ś ņĀäņ▓┤ņŚÉ Ļ▒Ėņ│É ņä¼ņ£Āņä▒ Ēö╝ļ¦ē ņ”ØņŗØ(fibrous ingrowth)ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. Ļ┤æļ▓öņ£äĒĢ£ ņżäĻĖ░ Ļ░ÖņØĆ ņä¼ņ£Āņä▒ ņĪ░ņ¦ü(fibrous tissue)ņØ┤ ĒīÉļ¦ēņŚÉ ļŗ©ļŗ©Ē׳ ļČÖņ¢┤ ņ׳ņŚłļŗż. ņżäĻĖ░ļź╝ ņ×Éļź┤ņ¦Ć ņĢŖĻ▓ī ņŻ╝ņØśĒĢśļ®┤ņä£ ņŚ¼Ļ│╝ĒżņŚÉņä£ ņä¼ņ£Āņä▒ Ēö╝ļ¦ēņØä ņ×ĪņĢä ļŗ╣Ļ▓© ņĀ£Ļ▒░ĒĢśņśĆļŗż. Ļ░ÖņØĆ ļ░®ļ▓Ģņ£╝ļĪ£ ņןņ╣śņØś ĒīÉĻ│╝ ĒīÉļ¦ē ņé¼ņØ┤ ĒŗłņāłņŚÉ ņ׳ļŖö ņżäĻĖ░ Ļ░ÖņØĆ ņä¼ņ£Āņä▒ Ēö╝ļ¦ēļÅä ņĀ£Ļ▒░ĒĢśņśĆļŗż(Fig. 1). ņČöĒøä ņ×¼ļ░£ ļ░®ņ¦Ćļź╝ ņ£äĒĢ┤ ņłśņłĀ ņżæ MMC (0.3 mg/mL)ļź╝ ņŖżĒÄĆņ¦ĆņŚÉ ņĀüņģö 2ļČäĻ░ä ņĀÉņĀüĒĢśņśĆļŗż.
ņłśņłĀ 1ņŻ╝ņØ╝Ļ╣īņ¦Ć ņÜ░ņĢł ņĢłņĢĢņØĆ Ļ│©ļō£ļ¦īņĢĢĒÅēņĢłņĢĢĻ│äņāü 5-9 mmHgļĪ£ ņĖĪņĀĢļÉśņŚłļŗż. ņłśņłĀ 2ņŻ╝ Ēøä ļ░®ņłśņ£ĀņČ£ņןņ╣śņØś ļģĖņČ£ņØ┤ ļ░£Ļ▓¼ļÉśņ¢┤ 10-0 ethilone ļ┤ēĒĢ®ņé¼ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ Ļ▓░ļ¦ē ļ┤ēĒĢ®ņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ļģĖņČ£ ļČĆņ£äņŚÉņä£ Ēģīļģ╝ļéŁĻ│╝ Ļ▓░ļ¦ēņØä ĒĢ£ ļ▓łņŚÉ Ļ░ÖņØ┤ ļ┤ēĒĢ®ĒĢśņśĆļŗż. ņłśņłĀ 3ņŻ╝ Ēøä ņןņ╣śĻ░Ć ņ×¼ļģĖņČ£ļÉśņ¢┤ ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņĀ£Ļ▒░ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż(Fig. 2). ņןņ╣ś ņĀ£Ļ▒░ Ēøä ņĢĮļ¼╝ ņ╣śļŻī ļ░Å ņĀäļ░®ņ▓£ņ×ÉņłĀ ļō▒ņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņÜ░ņĢł ņĢłņĢĢņØĆ Ļ│©ļō£ļ¦īņĢĢĒÅēņĢłņĢĢĻ│äņāü 40-50 mmHgļĪ£ ņĖĪņĀĢļÉśņ¢┤ 2021ļģä 2ņøö 9ņØ╝ ņÜ░ņĢł ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņłĀ Ēøä ņÜ░ņĢł ņĢłņĢĢņØĆ Ļ│©ļō£ļ¦īņĢĢĒÅēņĢłņĢĢĻ│äņāü 15-20 mmHgļĪ£ ņĖĪņĀĢļÉśņ¢┤ Ēśäņ×¼ Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ņżæņØ┤ļŗż.
ļ░®ņłśņ£ĀņČ£ņןņ╣śņéĮņ×ģņłĀņØĆ ļé£ņ╣śņä▒ ļģ╣ļé┤ņן ĒÖśņ×ÉņØś ņłśņłĀņĀü ņ╣śļŻīņŚÉ ĻĖ░ņĪ┤ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ ļīĆņŗĀ ņ×ÉņŻ╝ ņØ┤ņÜ®ļÉśļŖö ļ░®ļ▓ĢņØ┤ļŗż. Primary Tube Versus Trabeculectomy Study ļō▒ ĒāĆ ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ĻĖ░ņĪ┤ņØś ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀĻ│╝ ļ░®ņłśņ£ĀņČ£ņןņ╣śņéĮņ×ģņłĀņØä ļ╣äĻĄÉĒĢśņśĆņØä ļĢī ļæÉ ņłśņłĀ Ļ░äņØś ņä▒Ļ│ĄļźĀņØĆ ļ╣äņŖĘĒĢśņ¦Ćļ¦ī ĒĢ®ļ│æņ”Ø ļ░£ņāØļźĀņØ┤ ļ░®ņłśņ£ĀņČ£ņןņ╣śņéĮņ×ģņłĀņŚÉņä£ ļŹö ļé«ļŗżļŖö Ļ▓░Ļ│╝ļź╝ ņ¢╗ĻĖ░ļÅä ĒĢśņśĆļŗż[11]. ļ│Ė ņ”ØļĪĆņŚÉņä£ ņé¼ņÜ®ĒĢ£ ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śļŖö ļ¬Ėņ▓┤, Ļ┤Ć, ĒīÉļ¦ēņ£╝ļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ņ£╝ļ®░ 2ņןņØś ņŗżļ”¼ņĮś Ēāäņä▒ņżæĒĢ®ņ▓┤ ļ¦ē(silicone elastomer) ņé¼ņØ┤ņŚÉ ļü╝ņøīņĀĖ ļ¬Ėņ▓┤ņŚÉ ņŚ░Ļ▓░ļÉ£ ĻĄ¼ņĪ░ņØ┤ļŗż. ņØ┤ļĪĀņĀüņ£╝ļĪ£ 8 mmHg ņØ┤ņāüņ£╝ļĪ£ ņĢłņĢĢņØ┤ ņāüņŖ╣ĒĢĀ ļĢīļ¦ī ĒīÉļ¦ēņØ┤ ņŚ┤ļ”¼ļÅäļĪØ ļÉśņ¢┤ņ׳ņ¢┤ņä£ ņłśņłĀ Ēøä ņĀĆņĢłņĢĢņ”ØņŚÉ ļ╣Āņ¦ĆļŖö Ļ▓āņØä ļ░®ņ¦ĆĒĢĀ ņłś ņ׳ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[7].
ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņéĮņ×ģņłĀ Ēøä ĒĢ®ļ│æņ”Øņ£╝ļĪ£ ņĀäļ░®ņČ£Ēśł, Ļ┤ĆņØś ļ¦ēĒל, ņĀĆņĢłņĢĢ, ļ¦źļØĮļ¦ēļ░Ģļ”¼, ļ¦Øļ¦ēņČ£Ēśł, ņĢłĻĄ¼ļĪ£ ļō▒ņØ┤ ļéśĒāĆļéĀ ņłś ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. Ļ┤ĆņØś ļ¦ēĒלņØĆ ĒśłņĀä, ņä¼ņ£Āņä▒ ņĪ░ņ¦ü, ņ£Āļ”¼ņ▓┤, ĒÖŹņ▒ä ļō▒ņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢ£ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[7].
ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņéĮņ×ģņłĀ Ēøä ņä¼ņ£ĀņĢäņäĖĒż ņ”ØņŗØņ£╝ļĪ£ ņä¼ņ£Āņä▒ļ¦ēņØ┤ ĒśĢņä▒ļÉśņ¢┤ ņ£ĀņČ£ņןņ╣ś ļé┤ļČĆļĪ£ Ļ░Éņ×ģļÉĀ ņłś ņ׳ļŗż. ņØ┤ļĪ£ ņØĖĒĢ┤ ļ░®ņłśņ£ĀņČ£ ĒØÉļ”äņØ┤ ņĀĆĒĢ┤ļÉśņ¢┤ ņĢłņĢĢņØ┤ ņāüņŖ╣ĒĢśļŖö ļČĆņ×æņÜ®ņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż[12]. ņĀĆņ×ÉļōżņØĆ ņŚ¼Ļ│╝ĒżņŚÉ ĒśĢņä▒ļÉ£ ņä¼ņ£Āņä▒ Ēö╝ļ¦ēņØ┤ ļ░®ņłśņØś ņ£ĀņČ£ņØä ļ¦ēņØīņ£╝ļĪ£ņŹ© ņĢłņĢĢņØ┤ ņāüņŖ╣ĒĢśļŖö ņ”ØļĪĆņŚÉ ļīĆĒĢ┤ ļ│┤Ļ│ĀĒĢśņśĆļŗż. Trigler et al [13]ņØĆ 10ļģä ļÅÖņĢł ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņĀ£Ļ▒░ņłĀņØä ļ░øņØĆ ĒÖśņ×ÉļōżņŚÉ ļīĆĒĢ£ ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņĢäļ®öļō£ ņ£ĀņČ£ņןņ╣śņØś ĒīÉļ¦ē ļ░®(valve chamber)ņ£╝ļĪ£ ņä¼ņ£ĀĒśłĻ┤Ćņä▒ ņĪ░ņ¦üņØ┤ Ļ░Éņ×ģļÉśņ¢┤ ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņØś ņןņĢĀļź╝ ņ£Āļ░£ĒĢ£ ņ”ØļĪĆļōżņŚÉ ļīĆĒĢ┤ ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņ£Āņé¼ĒĢśĻ▓ī Kim et al [14]ņØĆ ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņłśņłĀ Ēøä ņĢłņĢĢ ņĪ░ņĀłņØ┤ ņל ļÉśņ¦Ć ņĢŖļŖö ĒÖśņ×ÉļōżņŚÉņä£ ņŚ¼Ļ│╝ĒżņŚÉ ĒśĢņä▒ļÉ£ Ēö╝ļ¦ēņØ┤ ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣ś ļé┤ ĒīÉļ¦ē ņé¼ņØ┤ņŚÉ Ļ░Éņ×ģļÉśņ¢┤ ņ׳ļŖö ĻĄŁļé┤ ņ”ØļĪĆņŚÉ ļīĆĒĢ┤ ļ│┤Ļ│ĀĒĢśņśĆļŗż. ļśÉĒĢ£ ņØ┤ļōżņØĆ ĒīÉļ¦ēņŚÉ Ļ░Éņ×ģļÉśņ¢┤ ņ׳ļŖö Ēö╝ļ¦ēņØä ņłśņłĀņĀü ļ░®ļ▓Ģņ£╝ļĪ£ ņĀ£Ļ▒░ĒĢ£ Ēøä ņĢłņĢĢņØ┤ ņĀĢņāüĒÖöļÉśņŚłņØīņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż.
ņŗĀņāØĒśłĻ┤Ćļģ╣ļé┤ņןņØĆ ĒŖ╣Ē׳ ļģ╣ļé┤ņןņłśņłĀ Ēøä Ļ│╝ļÅäĒĢ£ ņä¼ņ£ĀņĢäņäĖĒż ņ”ØņŗØņ£╝ļĪ£ ļ░®ņłśņ£ĀņČ£ļĪ£ņØś ĒÅÉņćäĻ░Ć ļ░£ņāØĒĢśĻĖ░ ņēĮĻ│Ā, ņØ┤ļĪ£ ņØĖĒĢ┤ ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņéĮņ×ģņłĀ Ēøä ņ┤łĻĖ░ņŚÉ ņĢłņĢĢņØ┤ ņāüņŖ╣ĒĢśļŖö ņØ┤ļźĖļ░ö hypertensive phaseĻ░Ć ļéśĒāĆļéśĻĖ░ļÅä ĒĢ£ļŗż. ņØ┤ ļĢīļ¼ĖņŚÉ ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣ś ņéĮņ×ģ ņŗ£ ņłśņłĀ Ļ│╝ņĀĢ ņżæ MMC Ēś╣ņØĆ ņłśņłĀ Ēøä 5-FU ļō▒ņØś ĒĢŁļīĆņé¼ņĀ£ļź╝ ļ│æņÜ®ĒĢśņŚ¼ ņé¼ņÜ®ĒĢ£ļŗż. ņłĀ ņżæ ļ░Å ņłĀ Ēøä ĒĢŁļīĆņé¼ņĀ£ļź╝ ņĢäļ®öļō£ņןņ╣śņÖĆ ļ│æņÜ®ĒĢśļ®┤ ņłĀ Ēøä ņāüņ▓ś ņ╣śņ£Ā Ļ│╝ņĀĢņ£╝ļĪ£ ņØĖĒĢ£ Ļ│╝ļŗżĒĢ£ ņä¼ņ£ĀĒÖö ļ░Å Ļ▓░ņ▓┤ ņĪ░ņ¦üņØś Ēö╝ļ¦ē ĒśĢņä▒ņØä ņ¢ĄņĀ£ĒĢśņŚ¼ ņĪ░ĻĖ░ ļ░®ņłś ņ£ĀņČ£ņØä ņ┤ēņ¦äņŗ£ņ╝£ ņłśņłĀ ņä▒Ļ│ĄļźĀņØä Ē¢źņāüņŗ£Ēé©ļŗż[10].
Lim et al [8]ņØĆ ņŗĀņāØĒśłĻ┤Ćļģ╣ļé┤ņן ĒÖśņ×É ņżæ ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņéĮņ×ģņłĀļ¦ī ņŗ£Ē¢ēļ░øņØĆ ļīĆņĪ░ĻĄ░Ļ│╝ ņłĀ ņżæ MMC ļ░Å ņłĀ Ēøä 5-FUļź╝ ļ│æņÜ®ĒĢ£ ņŗżĒŚśĻĄ░ņØä ļ╣äĻĄÉĒĢśņśĆļŗż. 24Ļ░£ņøöņØś Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ Ēøä ļīĆņĪ░ĻĄ░ņØś ļłäņĀü ņä▒Ļ│ĄļźĀ 19.1%, ņŗżĒŚśĻĄ░ņØś ļłäņĀü ņä▒Ļ│ĄļźĀ 43.7%ļĪ£ ĒĢŁļīĆņé¼ņĀ£ļź╝ ņØ┤ņÜ®ĒĢ£ ĻĘĖļŻ╣ņŚÉņä£ ņ╣śļŻī ņä▒Ļ│ĄļźĀņØ┤ ļåÆņĢśņØīņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż.
ņĀĆņ×ÉļōżņØĆ ņŗĀņāØĒśłĻ┤Ćļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņéĮņ×ģņłĀ Ēøä ņĢłņĢĢ ņĪ░ņĀłņØ┤ ļÉśņ¦Ć ņĢŖņĢä ņ×¼ņłśņłĀņØä ņŗ£Ē¢ēĒĢśņśĆĻ│Ā, ņłśņłĀ ņżæ ņä¼ņ£Āņä▒ Ēö╝ļ¦ēņØ┤ ĒīÉļ¦ē ļé┤ņŚÉ Ļ┤æļ▓öņ£äĒĢśĻ▓ī Ļ░Éņ×ģļÉśņ¢┤ ņ׳ļŖö Ļ▓āņØä ļ░£Ļ▓¼ĒĢśņśĆļŗż. ĻĖ░ņĪ┤ņØś ņłśņłĀņØä ĒåĄĒĢ┤ ņä¼ņ£Āņä▒ Ēö╝ļ¦ēņØä ņĀ£Ļ▒░ĒĢ£ Ēøä ņĢłņĢĢņØ┤ ņĀĢņāüĒÖöļÉ©ņØä Ļ┤Ćņ░░ĒĢśņśĆļŗż. ņØ╝ņĀäņØś ņŚ░ĻĄ¼ļōżņŚÉņä£ ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣ś ļé┤ļČĆņŚÉ ņä¼ņ£Āņä▒ Ēö╝ļ¦ēņØ┤ Ļ░Éņ×ģļÉśņ¢┤ Ļ┤Ć ĒÅÉņćäļź╝ ņ£Āļ░£ĒĢśņŚ¼ ņĢłņĢĢņØ┤ ņāüņŖ╣ĒĢśļŖö ņ”ØļĪĆņŚÉ ļīĆĒĢ┤ ļ│┤Ļ│ĀĒĢ£ ņĀüņØ┤ ņ׳ļŗż. ĻĘĖļ¤¼ļéś ļ│Ė ņ”ØļĪĆņ▓śļ¤╝ ņä¼ņ£Āņä▒ Ēö╝ļ¦ēņØ┤ ĒīÉļ¦ē ļé┤ņŚÉ Ļ┤æļ▓öņ£äĒĢśĻ▓ī Ļ░Éņ×ģļÉ£ Ļ▓ĮņÜ░ļŖö ļ│┤Ļ│ĀļÉ£ ņĀü ņŚåņŚłĻĖ░ņŚÉ ņĀĆņ×ÉļōżņØ┤ Ļ▓ĮĒŚśĒĢ£ ļō£ļ¼Ė ņ”ØļĪĆņŚÉ ļīĆĒĢ┤ ļ│┤Ļ│ĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
ļśÉĒĢ£ ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņéĮņ×ģņłĀ ņłĀ ņżæ ļ░Å ņłĀ Ēøä ĒĢŁļīĆņé¼ņĀ£ ņé¼ņÜ®ņØ┤ ņ╣śļŻī ņä▒Ļ│ĄļźĀņØä ļåÆņØ┤Ļ│Ā ĒŖ╣ļ│äĒĢ£ ļČĆņ×æņÜ®ņØä ņ£Āļ░£ĒĢśņ¦Ć ņĢŖļŖöļŗżļŖö ļ│┤Ļ│ĀļōżņØ┤ ļ¦Äņ£╝ļéś[8,10], ņĀĆņ×ÉļōżņØĆ ļ¦łņØ┤ĒåĀļ¦łņØ┤ņŗĀņØä ņØ┤ņÜ®ĒĢ£ ļÆż ņŗ£Ē¢ēĒĢ£ ņŚ¼Ļ│╝Ēżņ×¼ĒśĢņä▒ņłĀ Ēøä ņןņ╣ś ļģĖņČ£ļĪ£ ņØĖĒĢ┤ ņןņ╣ś ņĀ£Ļ▒░ņłĀņØä ņŗ£Ē¢ēĒĢ£ ņ”ØļĪĆļź╝ Ļ▓ĮĒŚśĒĢśņśĆļŗż. ļśÉĒĢ£ ņä¼ņ£Āņä▒ Ēö╝ļ¦ē ņ”ØņŗØņ£╝ļĪ£ ņØĖĒĢ£ ļ░®ņłśņ£ĀņČ£ņןņ╣ś ņŚ¼Ļ│╝Ēżņ×¼ĒśĢņä▒ņłĀņØś ņłĀ ņżæ ļ░Å ņłĀ Ēøä ĒĢŁļīĆņé¼ņĀ£ ņé¼ņÜ® Ēøä ņןņ╣śņØś ļģĖņČ£ņŚÉ ļīĆĒĢ┤ņä£ ļ│┤Ļ│ĀļÉ£ ņŚ░ĻĄ¼ļŖö ņŚåņŚłĻĖ░ņŚÉ ņØ┤ņŚÉ ļīĆĒĢ£ ņŻ╝ņØśļź╝ ļČłļ¤¼ ņØ╝ņ£╝ĒéżĻ│Ā ņłśņłĀ ņżæ ņé¼ņÜ® ņŗ£ ņŻ╝ņØśĒĢĀ ĒĢäņÜöĻ░Ć ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉśņ¢┤ ļ│Ė ņ”ØļĪĆļź╝ ļ│┤Ļ│ĀĒĢśĻ▓ī ļÉśņŚłļŗż. ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣ś ņéĮņ×ģ Ēøä Ļ┤æļ▓öņ£äĒĢ£ ņä¼ņ£Āņä▒ Ēö╝ļ¦ēņØś ņ”ØņŗØņ£╝ļĪ£ ņĢłņĢĢņØ┤ ĒĢ£ ļ▓ł ņś¼ļ×ÉĻĖ░ ļĢīļ¼ĖņŚÉ, ņŚ¼Ļ│╝Ēżņ×¼ĒśĢņä▒ņłĀ ņŗ£ ĒĢŁļīĆņé¼ņĀ£(anti-fibrotic agents)ņØś ĒÜ©Ļ│╝ļź╝ ļŹö ĻĖ░ļīĆĒĢśĻ│Āņ×É ļ¦łņØ┤ĒåĀļ¦łņØ┤ņŗĀņØä ņé¼ņÜ®ĒĢśņśĆņ£╝ļéś ņśżĒ׳ļĀż ļģĖņČ£ņØä ņ£Āļ░£ĒĢśĻ▓ī ļÉśņŚłļŗż. ņĢäņ¦üĻ╣īņ¦Ć ņŚ¼Ļ│╝Ēżņ×¼ĒśĢņä▒ņłĀ ņŗ£ņŚÉ ĒĢŁļīĆņé¼ņĀ£ņØś ņé¼ņÜ®ņŚÉ ļīĆĒĢ£ ņ×äņāü ņ¦Ćņ╣©ņØ┤ ņĀĢļ”ĮļÉśņ¢┤ ņ׳ņ¦Ć ņĢŖņĢä ņØ┤ņŚÉ ļīĆĒĢ£ ņČöĒøä ņČöĻ░Ć ņŚ░ĻĄ¼Ļ░Ć ņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
ļŗżļ¦ī ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņØś ļģĖņČ£ņØ┤ MMC ņé¼ņÜ® ņØ┤ņÖĖņŚÉļÅä ņä¼ņ£ĀĒÖö ņĪ░ņ¦ü ņĀ£Ļ▒░ ņŗ£ Ļ│╝ļÅäĒĢ£ ņŻ╝ļ│Ć ņĪ░ņ¦ü ņĀłņĀ£ļéś ņןņ╣ś ņŻ╝ļ│ĆņØś Ļ▓░ļ¦ēļ░Ģļ”¼Ļ░Ć ņČ®ļČäĒĢśņ¦Ć ņĢŖņĢä Ļ▓░ļ¦ē ļ┤ēĒĢ® ņŗ£ Ļ│╝ļÅäĒĢ£ ņĪ░ņ¦ü ņןļĀźļÅä ņ×¼ļģĖņČ£ņØś ņøÉņØĖņ£╝ļĪ£ ņ×æņÜ®ĒĢśņśĆņØä ņłś ņ׳ņ¢┤ ņØ┤ņŚÉ ļīĆĒĢ£ Ļ│ĀļĀżļÅä ĒĢäņÜöĒĢ┤ ļ│┤ņØĖļŗż. ļśÉĒĢ£ ņןņ╣ś ļģĖņČ£ ņŗ£ Ļ░ÉņŚ╝ņØś ņ¦ĢĒøäļŖö ņŚåņŚłĻĖ░ņŚÉ ņןņ╣ś ņĀ£Ļ▒░ ņÖĖņŚÉļÅä ņ×ÉĻ░Ć Ļ▓░ļ¦ēņØ┤ņŗØļÅä Ļ░ĆļŖźĒĢ£ ņ╣śļŻī ļ░®ļ▓ĢņØ┤ņŚłņØä Ļ▓āņ×äņØä Ļ│ĀļĀżĒĢ┤ ļ│╝ ņłś ņ׳ņØä ļō» ĒĢśļŗż.
ņĀĆņ×ÉļōżņØĆ ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņéĮņ×ģņłĀ Ēøä ņä¼ņ£Āņä▒ Ēö╝ļ¦ēņØś ņןņ╣śļé┤ Ļ░Éņ×ģņ£╝ļĪ£ ņŚ¼Ļ│╝Ēżņ×¼ĒśĢņä▒ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░, ņŗ£Ē¢ē ņżæņŚÉ Ļ┤æļ▓öņ£äĒĢ£ ņä¼ņ£Āņä▒ Ēö╝ļ¦ēņØś ņןņ╣śļé┤ Ļ░Éņ×ģņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ņŚ¼Ļ│╝Ēżņ×¼ĒśĢņä▒ņłĀ ņżæ ļ¦łņØ┤ĒåĀļ¦łņØ┤ņŗĀņØä ņé¼ņÜ®ĒĢśņśĆņ£╝ļ®░, ņØ┤Ēøä ņןņ╣ś ļģĖņČ£ļĪ£ ņØĖĒĢ┤ ļ░®ņłśņ£ĀņČ£ņןņ╣śņĀ£Ļ▒░ņłĀĻ╣īņ¦Ć ņŗ£Ē¢ēĒĢ£ ņ”ØļĪĆļź╝ Ļ▓¬ņŚłļŗż. ļ│Ė ņ”ØļĪĆļ│┤Ļ│Āļź╝ ĒåĄĒĢśņŚ¼ ņĢ×ņ£╝ļĪ£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņØś ņŚ¼Ļ│╝Ēżļ│ĄņøÉņłĀ ļ░Å ņ×¼ĒśĢņä▒ņłĀņŚÉņä£ Ļ┤æļ▓öņ£äĒĢ£ ņä¼ņ£Āņä▒ Ēö╝ļ¦ēņØś Ļ░Éņ×ģ Ļ░ĆļŖźņä▒ņŚÉ ļīĆĒĢ┤ ņØĖņ¦ĆĒĢśĻ│Ā, ĒĢŁļīĆņé¼ņĀ£ļź╝ ņé¼ņÜ® Ēøä ļ░®ņłśņ£ĀņČ£ņןņ╣śĻ░Ć ļģĖņČ£ļÉĀ Ļ░ĆļŖźņä▒ņŚÉ ļīĆĒĢ┤ ņŻ╝ņØśĻ░Ć ĒĢäņÜöĒĢĀ ņłś ņ׳ņØīņŚÉ ļīĆĒĢ┤ ĒÖśĻĖ░ĒĢśĻ│Āņ×É ĒĢ£ļŗż.
Figure┬Ā1.
Bleb encapsulation and surgical excision. (A) The broad stalk-like fibrous tissue was firmly adhered in the valve system. (B) The fibrous ingrowth over the entire valve system was confirmed. (B, C) The fibrous ingrowth was removed by pulling the connected bleb, taking care not to cut the stalk. Then the long, stalk-like fibrous ingrowth along the cleft between valve leaflets and the main plate was removed with same manner. (D) The broad stalk like fibrous tissue with encapsulated bleb.
REFERENCES
1) Molteno AC. New implant for drainage in glaucoma. Clinical trial. Br J Ophthalmol 1969;53:606-15.



2) Lloyd MA, Baerveldt G, Heuer DK, et al. Initial clinical experience with the baerveldt implant in complicated glaucomas. Ophthalmology 1994;101:640-50.


3) Schocket SS, Lakhanpal V, Richards RD. Anterior chamber tube shunt to an encircling band in the treatment of neovascular glaucoma. Ophthalmology 1982;89:1188-94.


4) Krupin T, Podos SM, Becker B, Newkirk JB. Valve implants in filtering surgery. Am J Ophthalmol 1976;81:232-5.


5) Joseph NH, Sherwood MB, Trantas G, et al. A one-piece drainage system for glaucoma surgery. Trans Ophthalmol Soc U K 1986;105(Pt 6):657-64.

6) Coleman AL, Hill R, Wilson MR, et al. Initial clinical experience with the Ahmed glaucoma valve implant. Am J Ophthalmol 1995;120:23-31.


7) Kim DH, Park CK, Ahn MD. Clinical results of Ahmed valve implantation in the aspects of complications. J Korean Ophthalmol Soc 2003;44:888-95.
8) Lim SH, Seo WM, Park JJ, Yun SU. Ahmed valve implantation with adjunctive mitomycin C and 5-fluorouracil: outcomes at 2 years. J Korean Ophthalmol Soc 2011;52:1470-7.

9) Lee SH, Ma KT, Hong YJ. Outcome of Ahmed valve implantation in refractory glaucoma. J Korean Ophthalmol Soc 2007;48:83-90.
10) Yoon HJ, Park JJ. Ahmed valve implantation with adjunctive mitomycin C and 5-fluorouracil: outcomes at one year. J Korean Ophthalmol Soc 2010;51:227-33.

11) Gedde SJ, Feuer WJ, Lim KS, et al. Treatment outcomes in the primary tube versus trabeculectomy study after 3 years of follow-up. Ophthalmology 2020;127:333-45.


12) Lee YW, Yim JH, Lee SB, Kim CS. The factors associated with the success of Ahmed glaucoma valve implantation. J Korean Ophthalmol Soc 2005;46:1509-17.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print